Атомная физика (физика атома)
Ключевые слова конспекта «Атомная физика (физика атома)»: планетарная модель атома Резерфорда, постулаты Бора, постоянная Планка, формула Бальмера, серия Бальмера, Лаймана, Пашена.
Раздел ЕГЭ по физике: 5.2. Физика атома.
Планетарная модель атома Резерфорда
Резерфорд, изучая рассеяние быстрых альфа-частиц при прохождении их через тонкую золотую фольгу, обнаружил, что все альфа-частицы рассеиваются на всевозможные углы, вплоть до углов, близких к 180°.
Ядерная модель атома (по Резерфорду): тяжелое положительное ядро, содержащее почти всю массу атома и заряд Z•e, е — заряд электрона, имеет радиус порядка 10–15 м. Вокруг него движутся электроны в пределах объема радиусом 10–10 м. Заряд ядра равен суммарному заряду электронов в электронной оболочке атома, следовательно, атом электрически нейтрален.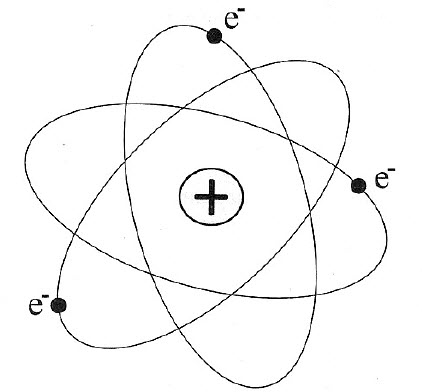
Противоречия модели атома (по Резерфорду)
- Обращающиеся вокруг ядра электроны обладают центростремительным ускорением, а значит, должны излучать. За счет кулоновских сил расстояние между электроном и ядром непрерывно уменьшается, а частота непрерывно растет и в рамках классической физики спектр излучения атома — непрерывный, что противоречит эксперименту.
- Атом с изменяющимися параметрами — неустойчив (электрон должен «упасть» на ядро), в действительности атомы устойчивы и в состоянии с минимальной энергией могут существовать неограниченно долго.
Оставаясь в рамках классической механики, Резерфорд не смог разрешить данные противоречия.
Постулаты Бора
- В атоме существуют устойчивые (стационарные) орбиты, движение электрона по которым не сопровождается излучением или поглощением энергии.
- При переходе атома из одного стационарного состояния в другое происходит излучение или поглощение кванта энергии:
h • vmn = Еm – Еn.
- Момент импульса электрона, находящегося на стационарной орбите, квантуется:
m • υn • rn = n • ħ,
где n — номер стационарной орбиты, ħ = h/2p = 1,05 • 10–34 Дж•с — постоянная Планка (аш (h) с чертой).
Боровская модель атома водорода. Серия Бальмера.
Спектры испускания и спектры поглощения
Атом с одним вращающимся вокруг ядра электроном называется водородоподобным атомом.
Боровская модель атома водорода описывает атом водорода и водородоподобные атомы.
Энергетический уровень — энергия, которой обладает электрон в атоме, находящемся в определенном стационарном состоянии.
Основное состояние атома — состояние с минимальной энергией.
Атом водорода имеет определенный спектр энергий. Состояние атома с n = 1 называют основным состоянием. Энергия основного состояния электрона в атоме водорода:
где k = 9•109 Н•м2/Кл2; m = 9,1 • 10–31 кг — масса электрона; е = –1,6 • 10–19 Кл — заряд электрона; h = 6,62 • 10–34 (Дж•с) — постоянная Планка.
Возбужденные состояния атома водорода — это состояния с номером п > 1, где п — главное квантовое число. Чем больше квантовое число п, тем дальше от ядра находится электрон, тем выше его энергетический уровень. Энергетический спектр атома водорода можно рассчитать:
Энергетический спектр водородоподобного атома рассчитывают с учетом Z —зарядового числа химического элемента:
Линейчатый спектр — спектр излучения, состоящий из отдельных узких спектральных линий различной интенсивности. Излучение, которое испускают атомы, образует линейчатый спектр.

Линейчатый спектр включает в себя резко очерченные цветные линии, которые обязательно отделяются друг от друга широкими темными промежутками. Расположение спектральных линий строго упорядочено и индивидуально для каждого вещества.
Формула, позволяющая найти частоты или длины волн, соответствующие линиям водородного спектра:

Атом испускает квант энергии, если m > n — все возможные частоты, вычисленные по данной формуле, дают спектр излучения атома водорода.
Атом поглощает квант энергии, если m < n. Спектр поглощения вещества получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии. Атом или молекула вещества поглощает излучение той же частоты, что и излучает, т. е. линии поглощения соответствуют линиям испускания — это закон обратимости спектральных линий Кирхгофа.
Энергетические уровни в атоме водорода принято обозначать горизонтальными линиями.

При n = 1 переходы с верхних уровней в основное состояние образуют серию Лаймана — ультрафиолетовая область спектра.

При n = 2 переходы с верхних уровней в первое возбужденное состояние образуют серию Бальмера — видимая часть спектра.
При n = 3 переходы с верхних уровней во второе возбужденное состояние образуют серию Пашена — инфракрасная часть спектра и т. д.
Формула Бальмера

Конспект урока по физике для класса «Атомная физика (физика атома)». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по физике для 7-11 классов
- Найти конспект через Кодификатор ОГЭ по физике
- Найти конспект через Кодификатор ЕГЭ по физике
