Электролиз расплавов и растворов.
Практическое применение электролиза
Ключевые слова конспекта: Электролиз растворов и расплавов электролитов. Практическое применение электролиза. Гальванопластика. Гальваностегия. Рафинирование.
Понятие об электролизе
В растворах и расплавах электролитов в электрическом поле упорядоченно движутся ионы в направлении, которое определяет их заряд. Ионы, несущие положительный заряд, направляются к отрицательно заряженному катоду и называются катионами; отрицательные ионы движутся к положительно заряженному аноду и называются анионами. Ионы достигают поверхности электродов и разряжаются на них, изменяя свой заряд. Так происходит окислительно-восстановительная реакция, в результате которой образуются новые вещества.
| Окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через растворы или расплавы электролитов, называется электролизом. |
Чем отличается электролиз от обычных окислительно-восстановительных реакций? Первое отличие очевидно: и окислителем, и восстановителем при электролизе является электрический ток. Второе отличие очень важно: процессы окисления и восстановления разделены в пространстве, так как они протекают не при контакте частиц друг с другом, а при соприкосновении с электродами электрической цепи.
Различают электролиз растворов и электролиз расплавов электролитов.
Электролиз расплавов электролитов
При расплавлении соединений с ионным видом связи (солей, щелочей) происходит их электролитическая диссоциация. Например, в расплаве хлорид натрия распадается на катионы натрия и хлорид-анионы: NaCl = Na+ + Cl–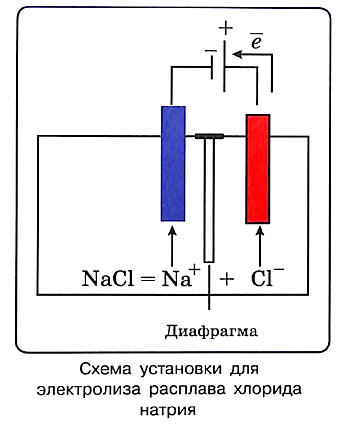
Если в расплав погрузить два электрода, движение ионов вместо хаотического становится направленным: под действием электрического поля катионы натрия устремляются к катоду, а анионы хлора — к аноду.
При соприкосновении с катодом ионы натрия принимают от него электроны и превращаются в атомы металла:
катод (–): Na+ + ē —> Na0 — восстановление
На аноде происходит окисление ионов хлора:
анод (+): 2Cl– – 2ē —> Сl20 — окисление
Суммарное уравнение электролиза расплава хлорида натрия можно отразить следующим образом:![]()
Обратите внимание, что под действием электрического тока протекает окислительно–восстановительная реакция, которая самопроизвольно не происходит. Именно поэтому над стрелкой в уравнении реакции обязательно нужно указать условие протекания процесса — электролиз.
Для разделения продуктов, получающихся на катоде и аноде, необходима диафрагма. Например, электролиз расплава гидроксида натрия протекает согласно уравнению: NaOH = Na+ + ОН–
катод (–): Na+ + ē —> Na0 — восстановление
анод (+): 4OН– – 4ē —> O20 + 2Н2O — окисление![]()
На катоде выделяется металлический натрий, на аноде — кислород и вода. Полупроницаемая диафрагма предохраняет щелочной металл от контакта с водой, разделяя катодное и анодное пространство.
Электролизом расплавов соединений в промышленности получают галогены, водород, кислород, а также активные металлы: щелочные, щёлочноземельные и алюминий. Именно электролизом знаменитый английский химик Гемфри Дэви (в честь которого была утверждена почётная награда — медаль Дэви) впервые получил калий, натрий, кальций и барий. За открытие фтора в 1906 г. французский химик Анри Муассан получил медаль Нобелевского лауреата.
Американский инженер Чарлз Холл в конце XIX в. открыл способ получения алюминия электролизом расплава глинозёмно-криолитной смеси (криолит понижал температуру плавления оксида алюминия). Затем в сотрудничестве с французским химиком Полем Эру он довёл до совершенства технологический процесс, который и лежит в основе современного производства алюминия. Сырьём для получения алюминия являются обезвоженные бокситы, или глинозём — оксид алюминия.
Электролиз растворов электролитов
Процесс протекает с участием молекул воды, которые в ряде случаев не остаются безразличными к электрическому заряду на электродах. Рассмотрим процессы, протекающие на катоде и аноде при электролизе растворов солей различных типов.
- Электролиз бромида меди(II). При растворении в воде бромид меди(II) диссоциирует в соответствии с уравнением CuBr2 = Сu2+ + 2Вг–
Если в раствор этой соли поместить два электрода, соединённые с источником постоянного тока, к катоду устремятся катионы меди, а к аноду — бромид–анионы. На электродах начнут протекать окислительно–восстановительные реакции:
катод (–): Сu2+ + 2ē —> Сu0 — восстановление
анод (+): 2Вг– – 2ē —> Вг20 — окисление![]()
- Электролиз водного раствора хлорида натрия. Эта соль диссоциирует по уравнению NaCl = Na+ + Сl–
Натрий — щелочной металл, поэтому на катоде восстанавливаются полярные молекулы воды:
Основными продуктами электролиза водного раствора хлорида натрия являются выделяющиеся на электродах водород и хлор, а в растворе образуется гидроксид натрия. Вместо катионов щелочных и щёлочноземельных металлов (например, бериллия, магния, алюминия, марганца) происходит восстановление воды с выделением на катоде газообразного водорода.
- Электролиз раствора сульфата меди(II). В водном растворе данная соль легко диссоциирует: CuSO4 = Cu2+ + SO42–
На катоде будут восстанавливаться ионы меди Сu2+:
катод (–): Сu2+ + 2ē —> Сu0 — восстановление
К аноду устремляются отрицательно заряженные ионы SO42–. Однако на нём окисляются молекулы воды:
анод (+): 2H2O – 4ē —> 4H + O20 — окисление![]()
На катоде осаждается металлическая медь, на аноде выделяется кислород, а в прианодном пространстве накапливается серная кислота.
Анионы кислородсодержащих кислот (![]() ), а также фторид–анионы при электролизе водных растворов солей (и кислот) на аноде не окисляются. Вместо этого происходит окисление воды: 2Н2O – 4ē —> 4H+ + O20
), а также фторид–анионы при электролизе водных растворов солей (и кислот) на аноде не окисляются. Вместо этого происходит окисление воды: 2Н2O – 4ē —> 4H+ + O20
- Электролиз раствора соли, состоящей из катиона щелочного металла и аниона кислородсодержащей кислоты. Рассмотрим процесс на примере нитрата калия: KNO3 = К+ + NO3–
Ни катион калия, ни нитрат–анион в присутствии воды не участвуют в окислительно–восстановительных процессах на электродах. Восстанавливается на катоде и окисляется на аноде вода.
Практическое применение электролиза
Основные направления промышленного применения электролиза:
- получение активных металлов (IA– и IIА–групп, а также алюминия);
- получение активных неметаллов (галогенов, водорода, кислорода);
- гальванопластика — получение металлических копий с металлического или неметаллического оригинала;
- гальваностегия — нанесение металлических или декоративных покрытий на изделия (главным образом металлические) — золочение, серебрение, никелирование, хромирование и др.;
- рафинирование — очистка от посторонних примесей цветных металлов.
Конспект урока по химии «Электролиз расплавов и растворов. Практическое применение электролиза». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
