Неорганические и органические кислоты
Ключевые слова конспекта: Кислоты в свете атомно-молекулярного учения. Кислоты в свете теории электролитической диссоциации. Кислоты в свете протонной теории. Общие химические свойства кислот. Неорганические и органические кислоты.
Определения кислоты.
Вспомним определение кислот в свете атомно-молекулярного учения. Кислоты — это сложные вещества, состоящие из атомов водорода, способного замещаться на металл, и кислотного остатка.
Почему в определении есть уточнение: «способного замещаться на металл»? Зная состав органических кислот, нетрудно объяснить это уточнение. Например, уксусная кислота содержит только один такой атом, хотя в её составе четыре атома водорода:
Mg + 2СН3СООН –> (CH3COO)2Mg + H2↑
Mg + 2CH3COOH = 2СН3СОO– + Mg2+ + H2↑
Дадим определение кислотам в свете теории электролитической диссоциации. Кислоты — это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотного остатка.
Газообразные аммиак и хлороводород взаимодействуют друг с другом с образованием твёрдых микроскопических частиц хлорида аммония, воспринимаемых наблюдателем как частички дыма: NH3 + НСl = NH4Cl
Этот эксперимент плохо объясняется с точки зрения теории электролитической диссоциации. Аналогичное явление наблюдается и при взаимодействии аммиака с газообразным метиламином с образованием хлорида метиламмония: CH3NH2 + НСl —> [CH3NH3]Cl
Мы подошли к рассмотрению кислот в свете протонной теории. Она получила такое название, поскольку, когда атом водорода теряет свой единственный электрон и превращается в катион водорода, остаётся ядро, состоящее из протона. Дадим определение кислотам с точки зрения протонной теории. Кислоты — это доноры катионов водорода.
Вспомним донорно-акцепторный механизм образования ковалентной связи при формировании катиона аммония:

Катионы водорода обусловливают изменение окраски индикаторов — фиолетового лакмуса и метилового оранжевого на красный, а также общие химические свойства кислот.
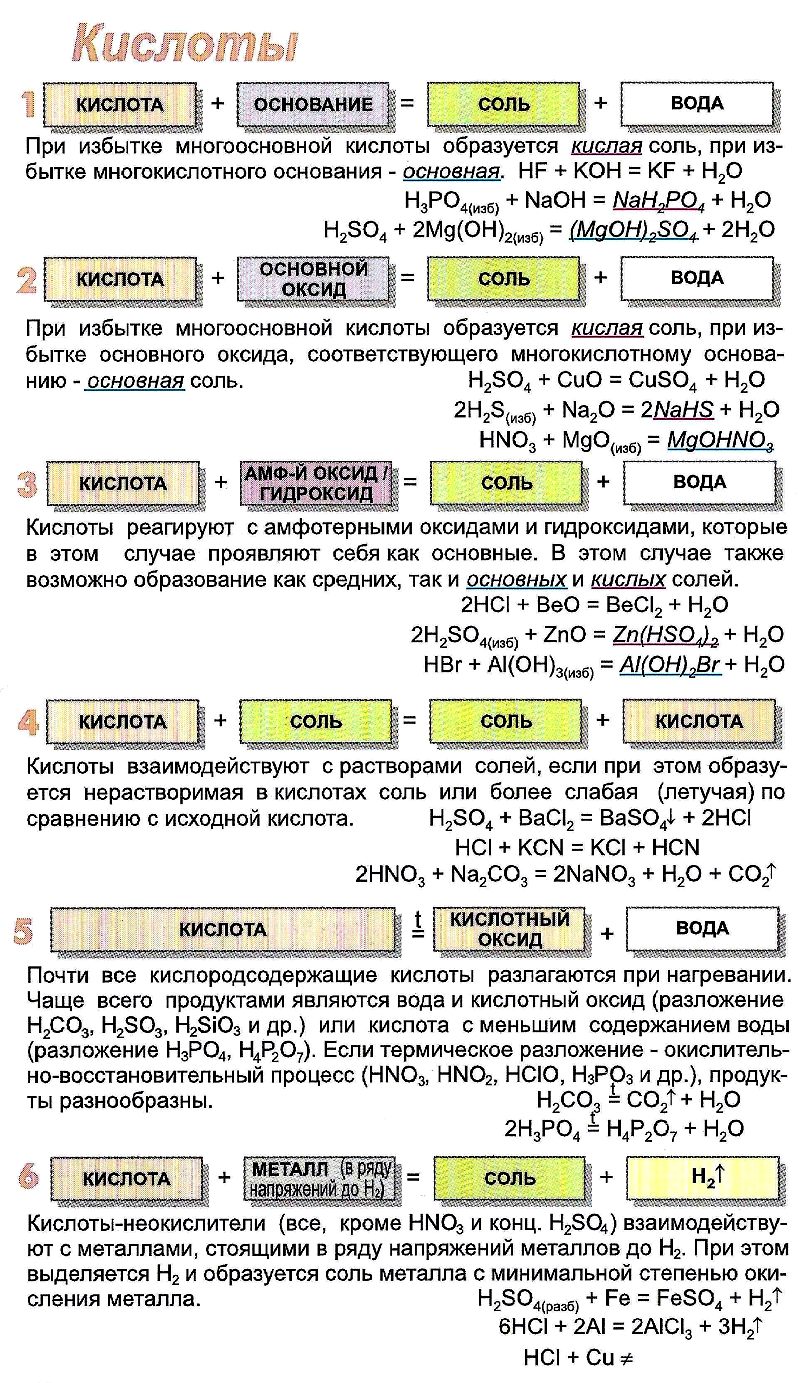
Химические свойства кислот.
- Органические и неорганические кислоты взаимодействуют с металлами при соблюдении определённых условий (вспомните их) с образованием соли и водорода:
2Аl + 6НСl = 2АlСl3 + 3H2↑
2Аl0 + 6Н+ = 2Аl3+ + 3Н2
2СH3СООН + Mg —> (CH3COO)2Mg + H2↑ - Кислоты взаимодействуют с основными и амфотерными оксидами, образуя соль и воду:
CuO + H2SO4 = CuSO4 + Н2O
CuO + 2H+ = Cu2+ + Н2O
ZnO + 2CH3COOH —> (CH3COO)2Zn + Н2O
ZnO + 2CH3COOH —> 2CH3COO– + Zn2+ + Н2O - Кислоты взаимодействуют с основаниями, образуя соль и воду:
LiOH + HNO3 = LiNO3 + Н2O
ОН– + Н+ = Н2O
Fe(OH)2 + 2НСl = FeCl2 + 2Н2O
Fe(OH)2 + 2Н+ = Fe2+ + 2Н2O
Са(ОН)2 + 2СН3СООН —> (СН3СОО)2Са + 2Н2O
ОН– + СН3СООН —> СН3СОО– + Н2O
- Кислоты взаимодействуют с солями, если в результате реакции образуется осадок, газ или малодиссоциирующее вещество:
K2SiO3 + 2HNO3 = H2SiO3↓ + 2KNO3
SiO32– + 2Н+ = H2SiO3↓
2СН3СООН + Na2CO3 —> 2CH3COONa + Н2O + CO2↑
2CH3COOH + CO32– —> 2CH3COO– + Н2O + CO2
NaNO2 + HCl = NaCl + HNO2
NO2– + H+ = HNO2 - Вступая в реакции этерификации, кислоты образуют сложные эфиры:

- Окислительные свойства кислот проявляются следующим образом: катионы водорода являются окислителем в реакциях кислот с металлами, однако окислителями могут быть и анионы кислотного остатка.
Например, нитрат-анион NO3– обладает сильными окислительными свойствами. Поэтому азотная кислота, несмотря на присутствие в растворе катионов водорода, совсем по-другому реагирует с металлами. Независимо от положения металла в электрохимическом ряду напряжений водород в таких реакциях не выделяется. Продуктами восстановления азотной кислоты могут быть оксиды азота, азот и даже аммиак (соли аммония):
Сu + 4НNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2Н2O
3Сu + 8HNO3(paзб.) = 3Cu(NO3)2 + 2NO↑ + 4Н2O
Взаимодействие концентрированной серной кислоты с металлами протекает с участием сульфат-аниона, и, как в случае с азотной кислотой, водород в таких реакциях не образуется:
Сu + 2Н2SO4(конц.) = CuSO4 + SO2↑ + 2Н2O
Окислительные свойства проявляют и органические кислоты. Например, муравьиная кислота, будучи веществом с двойственной природой — альдегидокислотой, даёт реакцию серебряного зеркала:
НСООН + Ag2O —> СO2 + Н2O + 2Ag↓
Дополнительные материалы (таблицы)


Конспект урока по химии «Неорганические и органические кислоты». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии

