Экспериментальные основы химии
Ключевые слова: экспериментальные основы химии, правила работы в лаборатории, правила безопасности, научные методы исследования химических веществ и превращений, индикаторы, качественные реакции на неорганические вещества и ионы, качественные реакции органических соединений, основные способы получения углеводородов, основные способы получения кислородсодержащих соединений.
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии.
Правила работы в лаборатории
- Каждый опыт выполняйте строго по инструкции в соответствии с рекомендациями преподавателя.
- Опыты с использованием или образованием вредных летучих веществ, а также газов с резким запахом проводите в вытяжном шкафу с включенным мотором.
- За ходом опыта в пробирке наблюдайте через её стенки. Нельзя смотреть на вещества в отверстие пробирки, особенно во время нагревания.
- Работая с огнём, будьте особенно внимательны и осторожны!
- Нагревайте пробирку с раствором или веществом равномерно. При этом запрещено наливать или насыпать в неё какое-либо вещество, ставить горячую пробирку в пластмассовый штатив.
- Категорически запрещается брать вещества руками, пробовать их на вкус, рассыпать, разбрызгивать или поджигать.
- Знакомясь с запахом вещества, делайте движения ладонью от отверстия сосуда к носу.
- Для опытов используйте только чистую лабораторную посуду.
- При попадании на кожу какого-либо вещества стряхните его, смойте достаточным количеством проточной воды и сразу обратитесь к учителю (лаборанту).
- После проведения опытов уберите рабочее место и тщательно вымойте руки с мылом.
- Не употребляйте пищу в химической лаборатории!
- При несчастном случае немедленно обратитесь к учителю.
Лабораторная посуда и оборудование
Стеклянная посуда:
- Делительная воронка — для отделения друг от друга несмешивающихся жидкостей.
- Колба коническая — для приготовления и хранения растворов.
- Колба круглодонная — для проведения синтезов.
- Кристаллизатор — для охлаждения растворов и при сборе газов под водой.
- Пробирка — для проведения самых разных опытов.
- Стеклянная палочка — для перемешивания жидкостей.
- Химическая воронка — для переливания жидкостей и для фильтрования.
- Химический стакан — для приготовления растворов и проведения химических реакций.
- Цилиндр — для собирания газов.
- Часовое стекло — для исследования твердых веществ, закрывания стаканов при проведении синтезов.
- Чашка Петри — для высушивания различных веществ.
Фарфоровая посуда:
- Тигель — для прокаливания веществ, для проведения различных синтезов при высоких температурах.
- Треугольник — для закрепления тиглей, чашек на кольце штатива.
- Фарфоровая ступка с пестиком — для измельчения твердых веществ, перемешивания смесей.
- Фарфоровая чашка — для упаривания растворов на водяной или песчаной бане.
- Фарфоровый шпатель — для пересыпания реактивов.
Оборудование:
- Ареометр — для измерения плотности раствора.
- Асбестовая сетка — для нагревания веществ на электрической плитке.
- Держатели для пробирок — для закрепления пробирок при нагревании.
- Ложка для сжигания вещества — для сжигания веществ.
- Муфельная печь — для прокаливания веществ, проведения синтеза при высокой температуре.
- Спиртовка — для нагревания веществ.
- Сушильный шкаф — для сушки веществ и посуды.
- Термометр — для определения температуры.
- Тигельные щипцы — для переноса небольших предметов.
- Штатив для пробирок — для проведения опытов в пробирках
- Штатив с кольцом, лапкой и зажимами — для закрепления приборов при проведении эксперимента.
- Электрические плитки — для нагревания веществ.
- Электронные весы — для взвешивания веществ.
Правила безопасности
при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
- При разбавлении кислот водой помните: наливают кислоту медленно, при перемешивании, в воду, а не наоборот.
- Кусочки щёлочи можно брать только пинцетом или щипцами. Растворяют щёлочь в фарфоровой посуде, прибавляя к воде небольшие порции вещества при помешивании.
- Пролитые кислоту или щёлочь следует засыпать чистым сухим песком и перемешать его до полного впитывания жидкости. Влажный песок убирают совком в широкий стеклянный сосуд для последующей промывки и нейтрализации.
- При попадании на кожу раствора кислоты необходимо обмыть кожу сильной струёй холодной воды, обработать 2%-ным раствором пищевой соды и ополоснуть водой.
- Работы, связанные с выделением вредных паров или газов, проводить только в вытяжном шкафу при включенной вентиляции.
- При попадании на кожу раствора щёлочи необходимо промыть кожу сильной струёй холодной воды, обработать 2%-ным раствором уксусной (или лимонной) кислоты.
- Внимательно читайте инструкцию и неукоснительно соблюдайте правила обращения с любым средством бытовой химии.
- Неукоснительно следуйте инструкции, касающейся срока годности любого препарата, особенно, если это — лекарства.
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ Методы исследования объектов, изучаемых в химии

Вы смотрите конспект «Экспериментальные основы химии»
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
Индикатор – это вещество, способное изменять окраску в растворах кислот и щелочей.
Таблица 4.1.3. Изменение окраски индикаторов в зависимости от среды раствора
| Индикатор | Нейтральная среда | Кислая среда | Щелочная среда |
| Лакмус | фиолетовый | красный | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метиловый оранжевый | оранжевый | розовый | жёлтый |
4.1.4. Качественные реакции на неорганические вещества и ионы
Таблица 4.1.4 а). Качественные реакции на катионы

Таблица 4.1.4 б). Качественные реакции на анионы

4.1.5. Качественные реакции органических соединений
Таблица 4.1.5. Качественные реакции на органические вещества.

4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
Способы получения простых веществ:
А) Получение водорода
- Взаимодействие металлов с кислотами (кроме азотной и концентрированной серной кислот):
Zn + H2SO4 (разб.) = ZnSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑ - Разложение воды под действием постоянного тока в присутствии сильного электролита (электролиз): 2H2O → 2H2↑(катод) + O2↑(анод)
- Взаимодействие амфотерных металлов с водой в щелочной среде: 2H2O + 2NaOH + Zn = Na2[Zn(OH)4] +H2↑
- Взаимодействие металлов с водой:
2H2O + 2Li = 2LiOH + H2↑
4H2O (пар) + 3Fe = (FeIIFe2III)O4 + 4H2↑ - Реакция гидридов металлов с водой: 2H2O + CaH2 = Ca(OH)2 + 2H2↑
- Взаимодействие углерода с водой: H2O + C (кокс) = CO + H2↑ (800-1000 °С)
- Конверсия метана (каталитический процесс): CH4 + H2O = CO + 3H2
Б) Получение кислорода
- Перегонка жидкого воздуха.
- Термическое разложение сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
2H2O2 = 2H2O + O2↑
В) Получение галогенов
- Электролиз: 2Cl– – 2e = Cl2
- Из солей с помощью более активного галогена или сильного окислителя: Cl2 + 2NaI = 2NaCl + I2
Г) Получение кремния
Восстановление коксом из кремнезема: SiO2 + 2C = Si + 2CO.
Д) Получение фосфора
Восстановление из фосфата кальция: Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
Вы смотрите конспект «Экспериментальные основы химии»
Способы получения оксидов
- Взаимодействие простых веществ с кислородом: 2Cu + O2 = 2CuO; S + O2 = SO2
Такие реакции, как правило, протекают с выделением значительного количества теплоты. - Взаимодействие сложных веществ с кислородом:
СН4 + 2O2 = СO2 + 2H2О
2СО + O2 = 2СO2 - Дегидратация гидроксидов: Mg(OH)2 →t→ MgO + H2O.
Гидроксиды щелочных металлов (кроме лития) плавятся без разложения.
2HIO3 →t→ I2O5 + H2O
6HNO3 + P2O5 = 3N2O5 + 2H3PO4 - Термическое разложение солей: CaCO3 →t→ CaO + CO2
Cульфаты и карбонаты щелочных металлов термически устойчивы. Они плавятся без разложения.
Способы получения оснований и амфотерных гидроксидов
- Взаимодействие щелочи или гидрата аммиака с растворимой солью соответствующего металла (нерастворимые основания и амфотерные гидроксиды): FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl.
Гидроксиды меди(I), серебра(I), золота(I) разлагаются на воду и оксид уже в процессе их образования, поэтому получить их из водного раствора не удается. - Взаимодействие металлов или их оксидов с водой (щелочи):
2Na + 2H2О = 2NaOH + H2↑
Na20 + H2О = 2NaOH.
Способы получения кислот
- Взаимодействие кислотных оксидов с водой:
SO3 + H2O = H2SO4
N2O5 + H2O = 2HNO3 - Реакция между сильной кислотой и солью слабой кислоты:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl - Из простых веществ (для бескислородных кислот): H2 + Cl2 = 2HCl.
Способы получения солей
- Действие растворов кислот на металлы: Ca + H2SO4(разб.) = CaSO4 + H2
- Взаимодействие основного или амфотерного оксида и кислоты:
Li2O + 2HNO3 = 2LiNO3 + H2O
BeO + 2HCl = BeCl2 + H2O. - Взаимодействие кислоты и основания (или амфотерного гидроксида):
CsOH + HI = CsI + H2O
Zn(OH)2(T) + 2HCl = ZnCl2 + 2H2O
KOH + Н3РО4 = КH2РО4 + H2О
2KOH + Н3РО4 = К2НРО4 + 2H2О
Al(OH)3(T) + 3H2SO4 = Al(HSO4)3 + 3H2O
Cu(NO3)2 + NaOH = CuOHNO3(T) + NaNO3. - Взаимодействие кислотного и основного или амфотерного оксидов: SrO + SO3 = SrSO4
- Реакции между основаниями и кислотными оксидами: Са(ОН)2 + СO2 = СаСО3 + H2O
- Действие сильной кислоты на соли слабой кислоты: NaNO2 + HCl = NaCl + HNO2
- Взаимодействие щелочей с солями, протекающее с образованием осадка:
2KOH + FeCl2 = Fe(OH)2↓ + 2KCl. - Обменные реакции между двумя солями (если образуются малорастворимые соли): Pb(NO3)2 + 2NaCl = PbCl2↓ + 2HNO3
- Термическое разложении солей другой кислоты: 2KNO3 = 2KNO2 + O2
- Взаимодействие металла и неметалла (некоторые соли бескислородных кислот): Ca + S = CaS.
- Вытеснение металла из раствора его соли более активным металлом (с учетом положения в ряду напряжений): Zn + CuSO4 = Cu + ZnSO4
- Действие кислотного оксида на соль соответствующей кислоты:
СаСО3 + СO2 + H2О = Са(НСО3)2 - Взаимодействие амфотерных металлов с щелочами:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑ - Взаимодействие амфотерных гидроксидов с щелочами:
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4].
Вы смотрите конспект «Экспериментальные основы химии»
4.1.7. Основные способы получения углеводородов (в лаборатории)
Основные способы получения углеводородов (в лаборатории) представлены в таблицах: а) Получение алканов; б) Получение алкенов; в) Получение алкадиенов; г) Получение алкинов; д) Получение аренов (бензола).
Таблица 4.1.7 а). Получение алканов.

Таблица 4.1.7 б). Получение алкенов.

Таблица 4.1.7 в). Получение алкадиенов.

Таблица 4.1.7 г). Получение алкинов.

Таблица 4.1.7 д). Получение аренов (бензола).

4.1.8. Основные способы получения кислородсодержащих соединений (в лаборатории)
Основные способы получения кислородсодержащих соединений (в лаборатории) представлены в таблицах: а) Получение спиртов; б) Получение фенола; в) Получение альдегидов; г) Получение кетонов; д) Получение карбоновых кислот; е) Получение сложных эфиров.
Таблица 4.1.8 а). Получение спиртов.

Таблица 4.1.8 б). Получение фенола.

Таблица 4.1.8 в). Получение альдегидов.

Таблица 4.1.8 г). Получение кетонов.

Таблица 4.1.8 д). Получение карбоновых кислот.
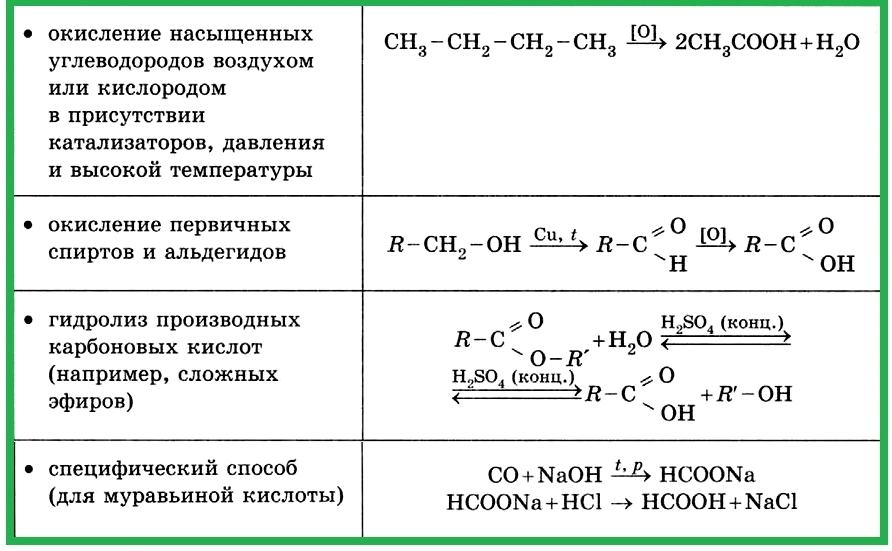
Таблица 4.1.8 е). Получение сложных эфиров.

(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Экспериментальные основы химии». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
