Карбоновые кислоты
Ключевые слова конспекта: Карбоновые кислоты. Предельные одноосновные карбоновые кислоты. Муравьиная кислота. Уксусная кислота.
Понятие и формулы карбоновых кислот
На любой кухне найдётся столовый уксус — 6%-ный раствор уксусной кислоты в воде. Наверняка в кухонном шкафу лежит и пакетик с лимонной кислотой, а в холодильнике — кисломолочные продукты, характерный вкус которым придаёт молочная кислота. Многие из вас пробовали на вкус прутик, атакованный муравьями в растревоженном муравейнике. Кислый вкус прутика обусловлен «химическим оружием» муравьёв — муравьиной кислотой.
Что общего между всеми упомянутыми веществами, кроме слова «кислота» в названии? Все они содержат в своём составе функциональную карбоксильную группу: 
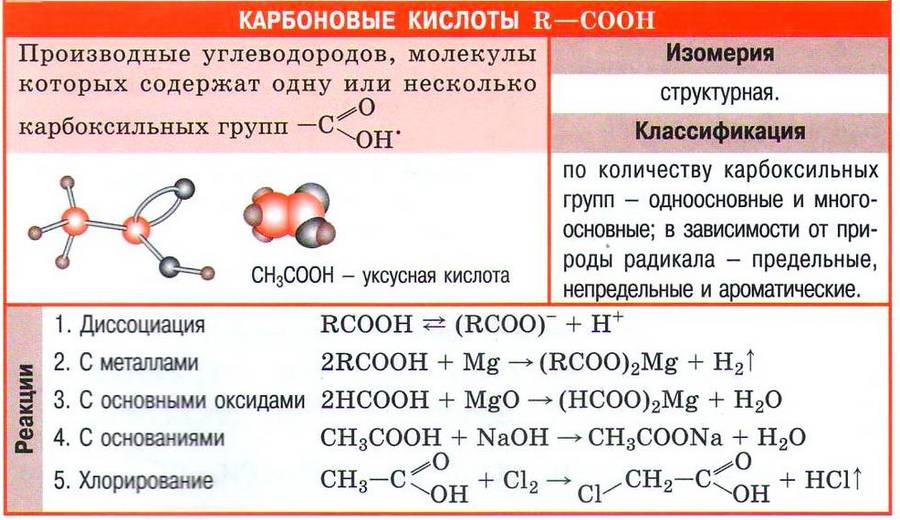
Органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом, называют карбоновыми кислотами.
 Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Однако в молекуле первого представителя гомологического ряда предельных одноосновных карбоновых кислот вместо углеводородного радикала с карбоксильной группой связан атом водорода. Эту кислоту называют муравьиной кислотой, её формула НСООН.
Формулы, а также тривиальные и международные названия некоторых представителей гомологического ряда предельных одноосновных карбоновых кислот приведены в таблице.
Обратите внимание, что тривиальные названия простейших альдегидов (см. табл.) аналогичны названиям соответствующих кислот. Это не случайно, поскольку свои названия альдегиды получили именно благодаря кислотам, в которые они превращаются при окислении. Для построения международного названия карбоновой кислоты к «имени» предельного углеводорода с тем же числом углеродных атомов добавляют сочетание —овая кислота. 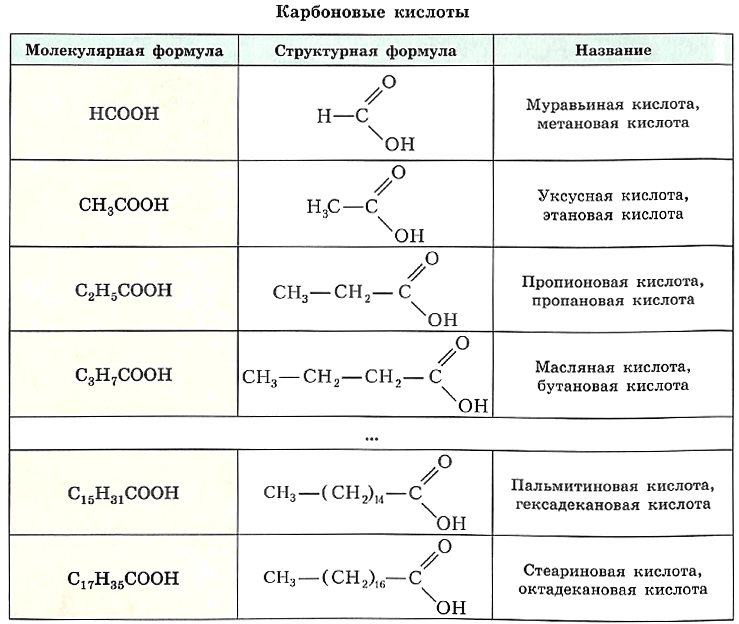
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые кислоты — жидкости с резким запахом, хорошо растворимые в воде. По мере роста углеводородного радикала растворимость кислот падает, температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты — твёрдые вещества, нерастворимые в воде.
Основным способом получения карбоновых кислот служат реакции окисления. Исходные вещества в подобных синтезах — спирты и альдегиды:
Пищевую уксусную кислоту получают биотехнологическим путём — сбраживанием сахарсодержащих растворов при действии особых микроорганизмов.
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Химические свойства карбоновых кислот
Следует учесть, что химические свойства карбоновых кислот, как и кислот неорганических, обусловлены их способностью диссоциировать с образованием катиона водорода:
Почему же в уравнении электролитической диссоциации соляной кислоты ставится знак равенства, а в аналогичном уравнении для уксусной кислоты — знак обратимости? Дело в том, что в отличие от соляной кислоты уксусная является слабой, распаду на ионы в водном растворе подвергается только небольшая часть её молекул.
Благодаря наличию в растворе катионов водорода карбоновые кислоты проявляют все характерные для кислот свойства: имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными и амфотерными оксидами, основаниями, солями. Рассмотрим свойства карбоновых кислот на примере уксусной кислоты СН3СООН.
Уксусная кислота реагирует с активными металлами с образованием солей (ацетатов) и выделением водорода:![]()
Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:![]()
При взаимодействии уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:![]()
С солями уксусная кислота также взаимодействует. В этом случае, как и для протекания любых реакций ионного обмена, должно выполняться одно из условий: образование осадка, выделение газа или образование слабого электролита. Например, при реакции уксусной кислоты с карбонатом кальция выделяется углекислый газ:![]()
Одно из важнейших химических свойств карбоновых кислот вам уже знакомо. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами, образуя сложные эфиры. Сама реакция вам уже знакома, это реакция этерификации. Так, в результате взаимодействия уксусной кислоты и этилового спирта образуется сложный эфир — этиловый эфир уксусной кислоты: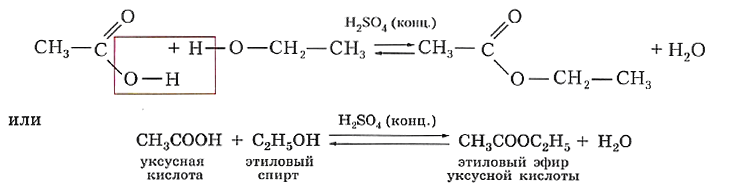
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах, не только придавая им кисловатый вкус, но и предохраняя их от порчи и поражения вредителями.
Муравьиная кислота выделяется железами внутренней секреции муравьёв и некоторых видов медуз. Жжение листьев крапивы также обусловлено раздражением кожи муравьиной кислотой.
Области применения карбоновых кислот в промышленности, в технике и технологии, в быту также весьма обширны. Муравьиную кислоту применяют для протравливания текстиля и бумаги, обработки кожи, получения лекарственных средств, как консервант фруктовых соков и зелёных кормов. Она входит в состав средства для местной анестезии. Её также используют при крашении тканей и бумаги.
Уксусную кислоту используют как приправу к пище, как растворитель лаков, для производства лекарственных средств, например аспирина, для получения пластмасс, ядохимикатов, красителей. В продаже встречается уксусная эссенция — 70%-ный раствор уксусной кислоты. С кислотой такой концентрации необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.
Справочная таблица «Карбоновые кислоты»

Конспект урока по химии «Карбоновые кислоты». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
