Хромосомная и генная инженерия. ГМО
Ключевые слова: хромосомная инженерия, генная инженерия, рестрикционные эндонуклеазы (рестриктазы); липкие концы; плазмиды; метод рекомбинантных плазмид; рестрикция, лигирование, трансформация, скрининг; трансгенные (генетически модифицированные) организмы, ГМО.
Раздел ЕГЭ: 3.9. Биотехнология, ее направления. Клеточная и генная инженерия, клонирование.
Учёные издавна мечтали целенаправленно изменять наследственность организмов, создавать новые комбинации хозяйственно ценных признаков. Современные исследователи приблизились к осуществлению этой мечты, овладев методами выделения из клеток хромосом, генов и их переноса в клетки другого организма. Осуществляет подобные эксперименты хромосомная и генная инженерия — перспективные направления биотехнологии.
Хромосомная инженерия
Манипуляции с целыми хромосомами или их участками называют хромосомной инженерией. Её методы дают возможность заменить одну или обе гомологичные хромосомы на другие или ввести дополнительные хромосомы в генотип организма.
Метод добавления хромосом в геном детально разработан на культурных злаках. Так, японский учёный Д. Омара внёс отдельные хромосомы ржи в хромосомный набор пшеницы. Полученный гибрид дал при самоопылении совершенно иные растения, которые отличались от пшеницы по высоте, толщине стебля, размеру и форме колосьев. Привнесённые хромосомы ржи дали возможность существенно повысить зимостойкость гибридной пшеницы, придали ей устойчивость к полеганию и к заболеваниям.
Генная инженерия
Генная инженерия решает задачу целенаправленного создания новых комбинаций генетического материала путём лабораторных методов in vitro, которые позволяют манипулировать нуклеиновыми кислотами, переносить нужные гены организма одного вида в организм другого вида.
Генная инженерия зародилась в начале 70-х гг. XX в., когда американский учёный X. Корана искусственно синтезировал ген, а П. Лобан и П. Берг получили рекомбинантную молекулу ДНК, в которой были соединены фрагменты ДНК вирусов и бактерии кишечной палочки (Escherichia coli). Генная инженерия возникла на стыке молекулярной биологии, микробиологии и энзимологии. Открытия в молекулярной биологии позволили выяснить структуру и особенности работы генов. Микробиология помогла найти векторы для генно-инженерных работ — плазмиды — внехромосомные факторы наследственности бактерий, состоящие из небольших кольцевых молекул ДНК. Энзимология предоставила исследователям ферменты, называемые рестрикционными эндонуклеазами или рестриктазами (от лат. restricts — ограничение), которые способны «узнавать» определённые последовательности нуклеотидов в ДНК и разрезать их так, чтобы на концах молекул образовывались одноцепочечные «хвосты». Эти «хвосты» могут снова по принципу комплементарности соединяться друг с другом, поэтому они были названы липкими концами.
В генной инженерии бактериальные клетки с новым генетическим материалом создают с помощью метода рекомбинантных плазмид. Он включает несколько последовательных этапов.
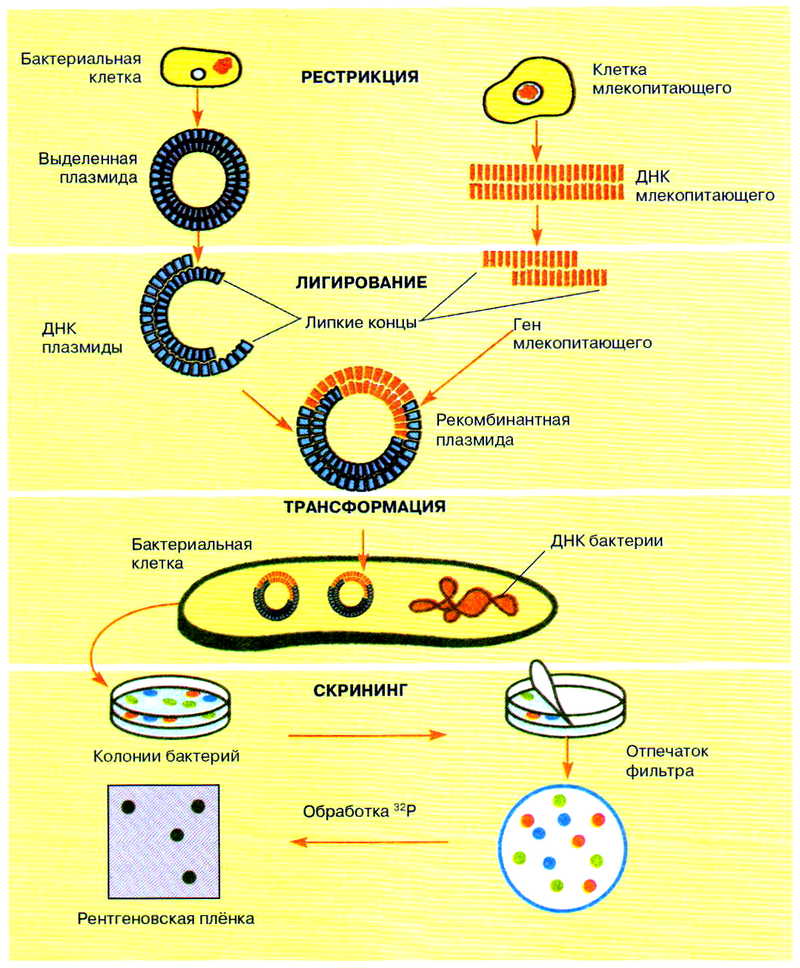
Метод рекомбинантных плазмид
- Рестрикция — разрезание молекулы ДНК, например клетки млекопитающего, ферментами-рекстриктазами на фрагменты с одинаковыми липкими концами и нужным геном. Такими же ферментами разрезают плазмидную ДНК, поэтому липкие концы плазмиды комплементарны нуклеотидным последовательностям липких концов гена. Ген можно синтезировать также искусственным путём с помощью матричных реакций. Такой синтез осуществляют с помощью фермента обратной транскриптазы, или ревертазы.
- Лигирование — «вшивание» гена с липкими концами в плазмидную ДНК с помощью ферментов-лигаз и получение рекомбинантной плазмиды.
- Трансформация — введение рекомбинантной плазмиды в бактериальную клетку. Для этого на клетку воздействуют высокой температурой и хлористым кальцием, что делает её оболочку проницаемой для ДНК. Внесённая в бактериальную клетку рекомбинантная плазмида начинает работать, и клетка синтезирует чужеродный белок. Частота попадания плазмиды в клетку невысока (в одну клетку из тысячи). Рекомбинантная плазмида в бактериальной клетке многократно удваивается, и чужеродный ген размножается, происходит его клонирование, т. е. передача от материнской клетки дочерним при бесполом размножении. От каждой бактериальной клетки образуется колония, состоящая из миллионов бактерий, которые подвергаются отбору — скринингу.
- Скрининг — отбор колоний бактерий, содержащих рекомбинантные плазмиды с нужным геном. Для этого все колонии накрывают специальным фильтром, к которому они прилипают. Затем фильтр обрабатывают радиоактивным зондом — полинуклеотидом, содержащим в своём составе радиоактивный изотоп фосфора — 32Р. Радиоактивный зонд комплементарен искомому гену, поэтому он связывается лишь с теми колониями бактерий, у которых имеются рекомбинантные плазмиды. Для их обнаружения на фильтр накладывают рентгеновскую плёнку, которую потом проявляют. По положению засвеченных на плёнке участков отбирают те колонии, которые получили нужный ген.
Методом рекомбинантных плазмид учёные создают штаммы бактерий, которые используются для производства в промышленном масштабе гормонов (инсулина, соматотропина), ферментов, белков-интерферонов, регуляторных пептидов и др. Этот же метод лежит в основе получения вакцин для борьбы с вирусами гепатита А и В, герпеса, гриппа, бешенства и ящура.
Создание трансгенных организмов (ГМО)
Клонированные гены путём микроинъекций могут быть введены в яйцеклетки, а из них выращены целые организмы, геном которых будет содержать чужеродные гены. Такие особи называют трансгенными (от лат. trans — сквозь, через) или генетически модифицированными организмами (ГМО).
В 1983 г. были получены первые трансгенные организмы — культурные растения табака и петуньи. Эти работы проводились учёными одновременно в Бельгии, Германии и США. Первой ГМО-культурой, коммерциализированной в Китае в 1992 году, стал табак, а первой ГМО-культурой, коммерциализированной в США в 1994 году, был томат FLAVR SAVR, разработанный для продления срока его хранения и минимизации размягчения фруктов. Этот томат не оправдал ожиданий, и его производитель прекратил продажи. С 1992 по 2020 год 41 страна пробовала выращивать ГМО-культуры. В настоящее время 28 стран ежегодно выращивают почти 200 млн га генетически модифицированных растений, что примерно в 113 раз больше, чем в 1996 году, когда их было 1,7 млн га. Биотехнологические культуры — это самая быстроразвивающаяся технология в истории современного сельского хозяйства.

Учёные создают трансгенные организмы с целью проявления у них новых хозяйственно ценных признаков. Например, при встраивании гена бактерии тюрингской бациллы (Bacillus thuringiensis), ответственного за выработку δ-эндотоксина, в генотип культурного картофеля получены так называемые Bt-растения картофеля (от названия вида бактерии), ядовитые для растительноядных насекомых, но безвредные для других животных и человека. Так был найден эффективный и экологически безопасный способ защиты культурного картофеля от его вредителя — колорадского жука.
(с) Genetic Literacy Project. Внедрение 22 различных культур в 41 странах мира с помощью трансгенеза, редактирования генов или других новых методов селекции (не все страны, которые ввели генетически модифицированные культуры за последние 28 лет, все еще выращивают их)
Получены трансгенные растения, устойчивые к гербицидам — ядам, применяемым для борьбы с сорняками. В настоящее время использование гербицидов сопряжено с рядом трудностей: универсальных препаратов не существует, т. е. каждый гербицид действует на определённые сорняки; гербициды накапливаются в почве, что угнетает развитие культурных растений и небезопасно для человека. Получение гербицидоустойчивых трансгенных культур стало выходом из сложившейся ситуации. Так, в клетки табака «вшили» гены бактерии сальмонеллы, обеспечивающие устойчивость к глифосату — наиболее часто используемому гербициду. Трансгенный табак стал невосприимчивым к этому препарату, кроме того, содержание глифосата в почве при выращивании такой генетически модифицированной культуры существенно снизилось. В настоящее время получение гербицидоустойчивых трансгенных культурных растений считается важным практическим достижением биотехнологии. В 1997 г. устойчивая к глифосату соя была признана в США сельскохозяйственным продуктом года.

TOP 5 BIOTECH CROPS IN THE WORLD. SOURCES: ISAAA Brief 54 (bit.ly/ISAAABrief54)
Предприняты попытки создания методами генной инженерии азотфиксирующих растений. Если удастся встроить в генотип сельскохозяйственных культур ген, отвечающий за выработку ферментов, превращающих у клубеньковых бактерий из рода Rhizobium атмосферный азот в азотистые соединения, то выращиваемые на полях сельскохозяйственные растения смогут обойтись без дополнительной подкормки азотными удобрениями.
Велико потенциальное значение трансгенных организмов для здоровья человека. Так, введение гена моркови в генотип риса уже сейчас обеспечивает потребность жителей Юго-Восточной Азии в витамине А, необходимом для нормального роста и зрения. Встраивание генов, отвечающих за выработку антител, в генотипы сельскохозяйственных растений позволит человеку в будущем обойтись без многих лекарств. При постоянном использовании таких растений в пищу организм будет получать достаточное количество антител, что создаст надёжную защиту от инфекционных болезней.
Важной задачей генной инженерии является создание трансгенных животных. На трансгенных лабораторных мышах учёные моделируют развитие и течение различных генетических болезней человека, проводят испытания лекарственных препаратов. Созданы трансгенные овцы, генотип которых содержит ген, отвечающий за синтез особого белка — фактора свёртываемости крови IX. Этот белок, вырабатываемый клетками молочной железы, выделяется из овечьего молока и используется для лечения больных гемофилией. Раньше подобный белок получали только из донорской крови. Использовать для этого трансгенных животных безопаснее, так как у них нет вирусов, например ВИЧ и гепатита, которые могут встречаться в донорской крови.
Это конспект по биологии для 10-11 классов по теме «Хромосомная и генная инженерия». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по Биологии.
- Найти конспект в Кодификаторе ЕГЭ по биологии

