Электролитическая диссоциация.
Степень диссоциации
Ключевые слова конспекта: электролитическая диссоциация, теория, электролиты, неэлектролиты, определения основаниям, кислотам и солям как электролитам, степень диссоциации, степень электролитической диссоциации.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Электрический ток – это направленное движение заряженных частиц. В металлах такое направленное движение осуществляется за счёт относительно свободных электронов. Но проводить электрический ток могут не только металлы.
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Почему же электролиты проводят электрический ток?
В 1887 г. шведский учёный Сванте Аррениус сформулировал положения теории электролитической диссоциации. Основная идея этой теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. Электропроводность электролитов обусловлена именно наличием в растворе свободных ионов, которые и являются носителями зарядов.
В дальнейшем теория электролитической диссоциации совершенствовалась. Современная теория водных растворов электролитов, кроме теории С. Аррениуса, включает в себя представления о гидратации ионов (И. А. Каблуков, В. А. Кистяковский) и теорию сильных электролитов (П. Й. Дебай, Э. А. Хюккель, 1923 г.).
Основными положениями теории электролитической диссоциации являются следующие:
- Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может происходить при плавлении твёрдых электролитов (термическая диссоциация электролитов).
- Ионы отличаются от атомов по составу и по свойствам. В водных растворах ионы находятся в гидратированном состоянии. Ионы в гидратированном состоянии отличаются по свойствам от ионов в газообразном состоянии вещества.
- В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании через раствор или расплав электролита электрического тока ионы движутся направленно: катионы – к катоду, анионы – к аноду.
ОПРЕДЕЛЕНИЯ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
В свете теории электролитической диссоциации можно дать определения основаниям, кислотам и солям как электролитам.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов – гидроксид-анионы OH–:
КОН = К+ + OH–
Са(ОН)2 = Са2+ + 2 OH–
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н+ (точнее – катионы гидроксония H3O+).
Катион гидроксония образуется при взаимодействии Н+ с молекулой H2O. В результате образуется ещё одна ковалентная связь кислорода с водородом по донорно-акцепторному механизму:
Н+ + H2O = H3O+
Примеры диссоциации кислот:
НCl = Н+ + Cl– или НCl + H2O = H3O+ + Cl–
НСlO4 = Н+ + СlO4– или НСlO4 + H2O = H3O+ + СlO4–
Многоосновные кислоты диссоциируют ступенчато:
Суммарное уравнение: H2SO4 + 2Н2О = 2H3O+ + SO4
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка.
Средние соли диссоциируют с образованием только катионов металла и анионов кислотного остатка. Например:
Соли аммония вместо катиона металла содержат катион аммония. Например:
NH4Cl = NH4+ + Cl–
Основные соли диссоциируют с образованием катионов металла, анионов ОН– и анионов кислотного остатка:

Суммарное уравнение: AlOНCl2 = Al3+ + ОН– + 2Cl–
Кислые соли диссоциируют с образованием катионов металла, катионов водорода (гидроксония) и анионов кислотного остатка. Например:

Суммарное уравнение: Са(НСO3)2 + 2H2O = Са2+ + 2H3O+ + 2СО32–
Двойные соли – соли, в результате диссоциации которых образуются катионы нескольких металлов (или аммония и какого–либо металла) и анионы одного кислотного остатка. Например, сульфат калия–хрома (хромокалиевые квасцы):
KCr(SO4)2 = К+ + Cr3+ + 2SO42–
Смешанные соли – соли, в результате диссоциации которых образуются катионы какого-либо металла и анионы нескольких кислотных остатков. Например, хлорид-гипохлорит кальция (хлорная известь):
СаСlOCl = Са2+ + Cl– + СlO–
При растворении одних электролитов диссоциация происходит практически полностью. Такие электролиты называют сильными. При растворении других электролитов диссоциация происходит в незначительной мере, их называют слабыми.
СТЕПЕНЬ ДИССОЦИАЦИИ
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
Степень электролитической диссоциации (α) – отношение количества вещества электролита, распавшегося на ионы (nрасп.), к количеству вещества электролита, поступившего в раствор (nобщ.):
Степень диссоциации также выражают в процентах, тогда 0% < α < 100%.
Степень электролитической диссоциации зависит от природы электролита, его концентрации в растворе и температуры. С разбавлением и с повышением температуры степень электролитической диссоциации возрастает.
Оценить силу различных электролитов можно, сравнивая степень их электролитической диссоциации при одинаковых условиях:
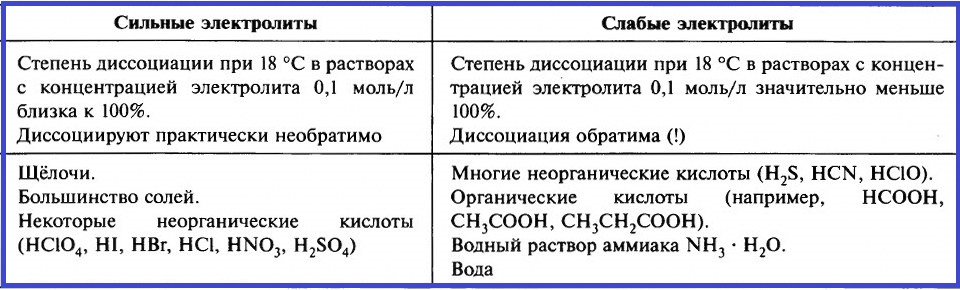
Всё об электрической диссоциации кратко в одной таблице.

Всё об электрической диссоциации кратко в одной таблице.
Конспект урока «Электролитическая диссоциация. Степень диссоциации».
Следующая тема: «Реакции ионного обмена. Ионное уравнение».
