Оксиды
(названия, классификация, получение)
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства, степень окисления.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2. (Подробнее про степень окисления смотрите в конце статьи)
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
Оксиды подразделяют на солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (безразличные). Особое положение у оксида «вода».
Названия оксидов
Названия оксидов состоят из двух слов: 1-е – «оксид», 2-е – название элемента в родительном падеже. Например, СаО – оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3— оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.

Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Часто используют и другие наименования оксидов. Например, по числу атомов кислорода (современная международная номенклатура): если оксид содержит только один атом кислорода, то его называют монооксидом (устаревшее — окись), если два — диоксидом (устаревшее — двуокись), если три — то триоксидом (устаревшее — триокись, трёхокись) и т. д.
Современная международная номенклатура оксидов состоит в использовании приставок по числу атомов в формульной единице оксида (моно-, ди-, три-, тетра-, пента-, гекса-, гепта-). Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Про названия окись, закись и перекись смотрите в разделе «Степень окисления» (в конце статьи).
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.
Примечание. Не во всех учебниках и литературе встречается такое систематическое название как несолеобразующие оксиды. Например, соединение F2O в одних учебниках называют оксидом фтора. По другой систематизации — окись фтора. Однако, по правилам IUPAC это соединение должно называться фторид кислорода (OF2), потому как так как атом фтора более электроотрицателен чем кислород.
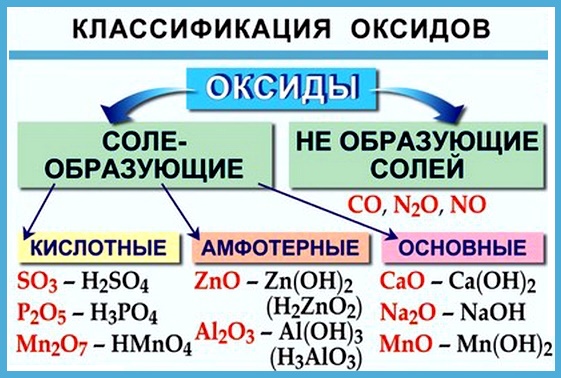
Вот некоторые правила образования солеобразующих оксидов:
- неметаллы образуют только кислотные оксиды;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
Предсказать свойства оксида металла может помочь эта схема.
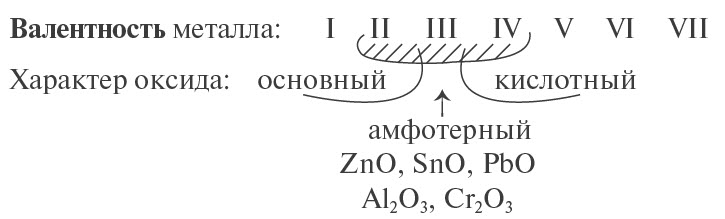
Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
Схема определения типа оксида: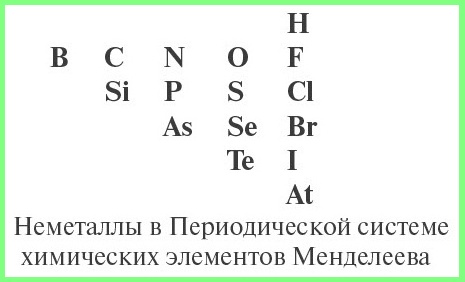
- определить, не является ли данный оксид несолеобразующим;
- определить, какой элемент входит в состав оксида: металл или неметалл, для чего нужно знать из таблицы Менделеева символы элементов — неметаллов.
- если в состав оксида входит атом неметалла — то оксид кислотный;
- для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
Например:
- Сг2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- CrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:
4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;
SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:
Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:
СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
Химические свойства оксидов
1. При разложении (при нагревании) неустойчивых оксидов – оксида серебра Ag2O и оксида ртути (II) HgO – образуется соответствующий металл и кислород:
2Ag2O = 4Ag + O2 ↑, 2HgO = 2Hg + O2 ↑.
2. Некоторые oксиды при нагревании образуют другие оксиды. Так, из красного оксида хрома (VI) получается зеленый оксид хрома (III): 4СrO3 = 2Сr2O3 + 3O2 ↑.
3. Некоторые oксиды металлов и неметаллов реагируют с водой:
СаО + Н2O = Са(ОН)2, SO3 + Н2O = Н2SO4.
4. Oксиды металлов обычно реагируют с оксидами неметаллов:
СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.
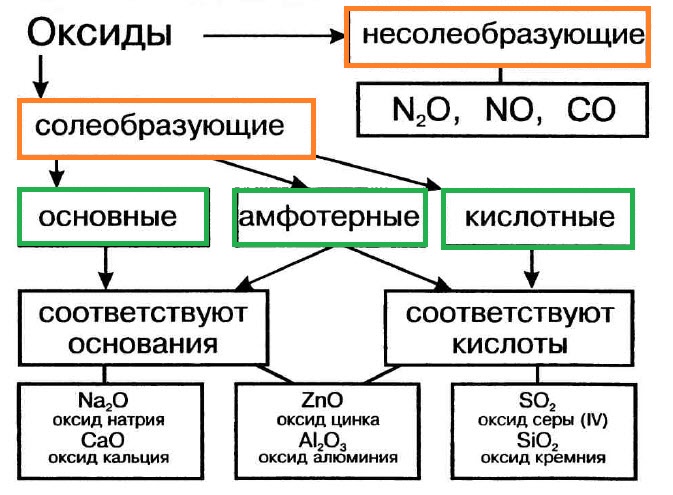
Оксиды (справочная таблица)

Степень окисления (закись, окись, перекись)
Степень окисления (окислительное число) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле. Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Степень окисления атома любого элемента в свободном (несвязанном) состоянии (простое вещество) равна нулю, так, например, атомы в молекулах имеют нулевую степень окисления. Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в комплексном ионе (катионе либо анионе) должна быть равна его общему заряду.
Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O, то есть в подавляющем большинстве соединений — оксидах. Так, степень окисления кислорода в абсолютном большинстве случаев равна −2 (H2O, H2SO4, NO, CO2 и CH3OH), но в пероксиде водорода (H2O2 или HO—OH), она равна −1.
Закись — низшая степень окисления. Соединение элементов низкой степени окисления с кислородом. Пример: Cu2O — закись меди, оксид меди(I).
Окись — промежуточная степень окисления. Соединение элементов средней степени окисления с кислородом. Пример: СО — окись углерода (бытовое название: угарный газ), оксид углерода (II), монооксид углерода.
Перекись — высшая степень окисления вещества. Соединение элементов высокой степени окисления с кислородом. Пример: Н2О2 — перекись водорода, пероксид водорода (НЕ оксид !)
Пероксиды (перекиси) — соединения, содержащие атомы кислорода, соединённые между собой (O—O), называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов. Пероксиды легко выделяют кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для органических веществ и сегодня в русском языке часто используют термин перекись. Пероксиды многих органических веществ взрывоопасны. Наиболее известна ПЕРЕКИСЬ ВОДОРОДА (HO—OH) — жидкость, состоящая из водорода и кислорода, обычно продается в водных растворах. Раствор перекиси водорода используется как отбеливающие и дезинфицирующие средство. Концентрированная перекись водорода — опасное взрывчатое вещество и используется как окислитель для ракетного топлива.
Вы смотрели конспект урока по химии «Оксиды (названия, классификация, получение, свойства)». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Перейти к следующей теме: «Свойства солеобразующих оксидов».

11 Комментарии
Спасибо, пока ОРВИ понял тему даже дома.
я тоже
Спосибо теперь-то я знаю откуда нам училка берëт нам конспекты
ЛУЧШИЙ САЙТ СПАСИБО!!!!!!!
Незаменимый сайт. Спасибо!
Думается, стоит упомянуть здесь закиси и перекиси.
лучший сайт
F2O не оксид же? Фторид , наверное стоит убрать из конспекта
Есть учебники, в которых до сих пор F2O — несолеобразующий оксид. Однако мы добавили пояснение относительно фторида кислорода (OF2).
Крутой сайт! Коротко и ясно. Спасисбо!!! ❤❤❤
Хорошо бы ещё выписать продукты реакций оксидов с другими вещ-ми