Углерод и кремний. Элементы IVA-группы
Ключевые слова конспекта: углерод, кремний, элементы IVA-группы, свойства элементов, алмаз, графит, карбин, фуллерен.
Элементы IV группы – это углерод, кремний, германий, олово и свинец. Более подробно рассмотрим свойства углерода и кремния. В таблице приведены важнейшие характеристики этих элементов.
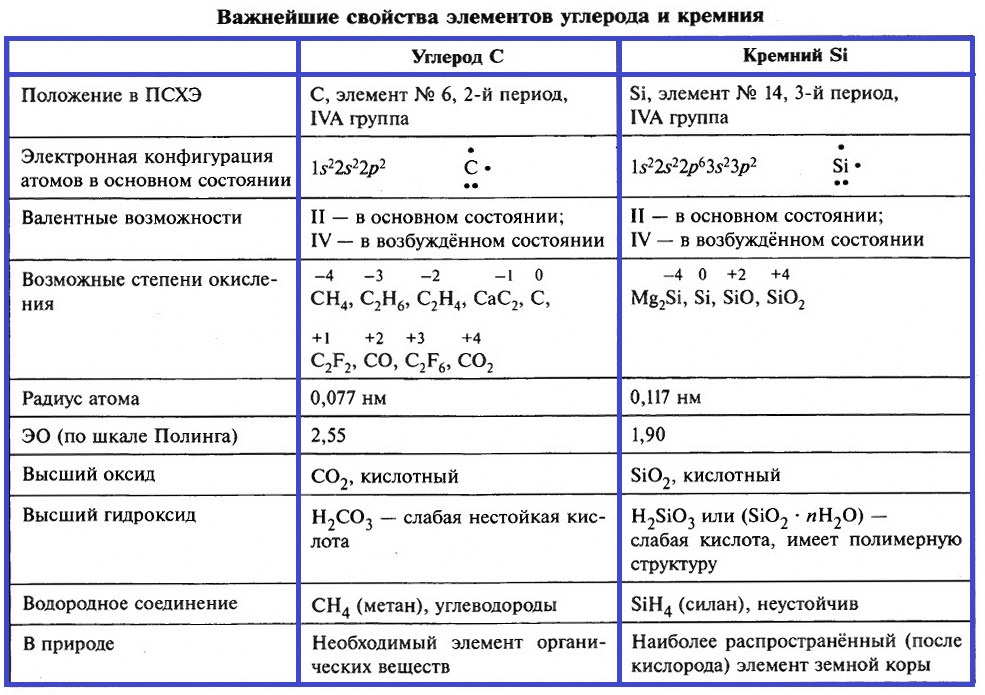
Почти во всех своих соединениях, углерод и кремний четырёхвалентны, их атомы находятся в возбуждённом состоянии. Конфигурация валентного слоя атома углерода при возбуждении атома меняется:
Аналогично меняется конфигурация валентного слоя атома кремния:
На внешнем энергетическом уровне атомов углерода и кремния находится 4 неспаренных электрона. Радиус атома кремния больше, на его валентном слое имеются вакантные 3d–орбитали, это обусловливает отличия в характере связей, которые образуют атомы кремния.
Степени окисления углерода меняются в интервале от –4 до +4.
Характерной особенностью углерода является его способность образовывать цепи: атомы углерода соединяются друг с другом и образуют устойчивые соединения. Аналогичные соединения кремния неустойчивы. Способность углерода к цепеобразованию обусловливает существование огромного числа органических соединений.
К неорганическим соединениям углерода относятся его оксиды, угольная кислота, карбонаты и гидрокарбонаты, карбиды. Остальные соединения углерода являются органическими.
Для углерода–элемента характерна аллотропия, его аллотропными модификациями являются алмаз, графит, карбин, фуллерен. Сейчас известны и другие аллотропные модификации углерода.
Уголь и сажу можно рассматривать как аморфные разновидности графита.
Кремний образует простое вещество – кристаллический кремний. Существует аморфный кремний – порошок белого цвета (без примесей).
Свойства алмаза, графита и кристаллического кремния приведены в таблице.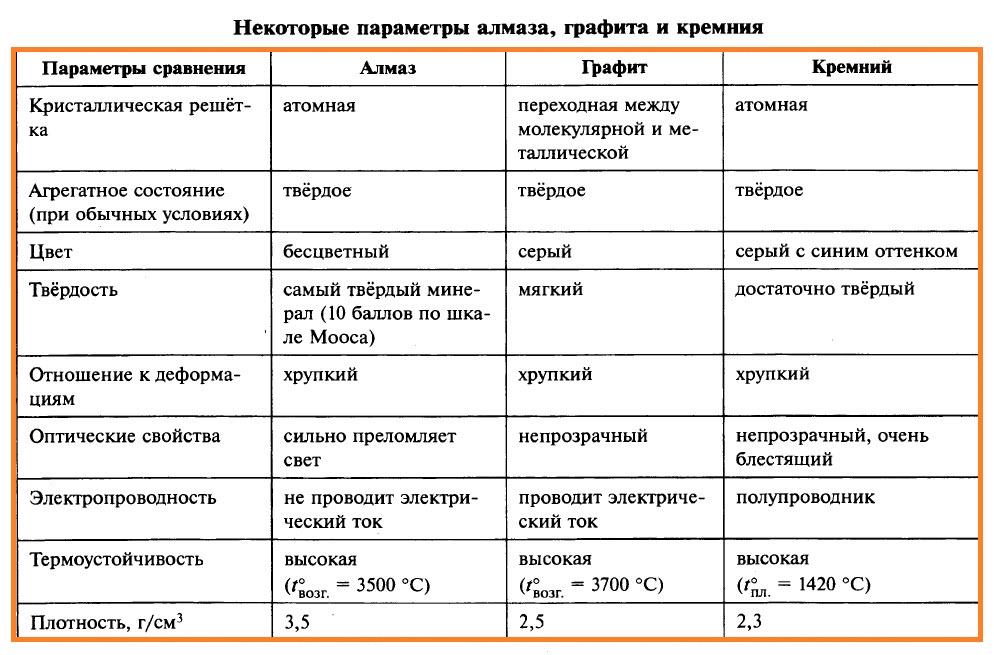
Причина явных отличий в физических свойствах графита и алмаза обусловлена различным строением кристаллической решётки. В кристалле алмаза каждый атом углерода (исключая те, которые находятся на поверхности кристалла) образует четыре равноценные прочные связи с соседними атомами углерода. Эти связи направлены к вершинам тетраэдра (как в молекуле СН4). Таким образом, в кристалле алмаза каждый атом углерода окружён четырьмя такими же атомами, располагающимися в вершинах тетраэдра. Симметричность и прочность С–С-связей в кристалле алмаза обусловливают исключительную прочность и отсутствие электронной проводимости.
В кристалле графита каждый атом углерода образует три прочные равноценные связи с соседними атомами углерода в одной плоскости под углом 120°. В этой плоскости образуется слой, состоящий из плоских шестичленных колец.
Кроме того, каждый атом углерода имеет один неспаренный электрон. Эти электроны образуют общую электронную систему. Связь между слоями осуществляется за счёт относительно слабых межмолекулярных сил. Слои расположены один относительно другого таким образом, что атом углерода одного слоя находится над центром шестиугольника другого слоя. Длина связи С–С внутри слоя составляет 0,142 нм, расстояние между слоями – 0,335 нм. В результате связи между слоями гораздо менее прочны, чем связи между атомами внутри слоя. Это обусловливает свойства графита: он мягок, легко расслаивается, имеет серый цвет и металлический блеск, электропроводен и химически более активен, чем алмаз. Модели кристаллических решёток алмаза и графита изображены на рисунке.

Возможно ли превратить графит в алмаз? Такой процесс осуществим в жёстких условиях – при давлении примерно 5000 МПа и при температуре от 1500 °С до 3000 °С в течение нескольких часов в присутствии катализаторов (Ni). Основную массу продукции составляют небольшие кристаллы (от 1 до нескольких мм) и алмазная пыль.
Карбин – аллотропная модификация углерода, в которой атомы углерода образуют линейные цепи типа:
–С≡С–С≡С–С≡С– (α–карбин, полиин) или =С=С=С=С=С=С= (β–карбин, полиен)
Расстояние между этими цепями меньше, чем между слоями графита, за счёт более сильного межмолекулярного взаимодействия.
Карбин представляет собой чёрный порошок, является полупроводником. Химически он более активен, чем графит.
Фуллерен – аллотропная модификация углерода, образованная молекулами С60, С70 или С84. На сферической поверхности молекулы С60 атомы углерода располагаются в вершинах 20 правильных шестиугольников и 12 правильных пятиугольников. Все фуллерены представляют собой замкнутые структуры из атомов углерода. Кристаллы фуллерена относятся к веществам с молекулярным строением.
Кремний. Существует только одна устойчивая аллотропная модификация кремния, кристаллическая решётка которой подобна решётке алмаза. Кремний – твёрдое, тугоплавкое (t°пл = 1412 °С), очень хрупкое вещество тёмно-серого цвета с металлическим блеском, при стандартных условиях – полупроводник.
Конспект урока по химии «Углерод и кремний. Элементы IVA-группы». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ещё конспекты по теме «Углерод и кремний«:
