Химические свойства водорода
Ключевые слова конспекта: химические свойства водорода, применение водорода,
Водород при комнатной температуре малоактивен. При нагревании водород реагирует со многими простыми и сложными веществами.
Реакции соединения
В реакциях с неметаллами водород является восстановителем. При поджигании на воздухе водород сгорает или реагирует с кислородом с взрывом:
2Н2 + О2 = 2Н2O.
При поджигании водород реагирует с газом хлором Сl2 (на ярком свету — с взрывом) с образованием газа хлороводорода НСl.
Н2 + Сl2 = 2НСl.
Реакции с бромом и йодом обратимы и протекают при 400-500 °С.
При температуре 150-200 °С водород реагирует с серой, при этом получается газообразный сероводород:
Н2 + S = H2S.
При более высокой температуре идет заметное разложение сероводорода.
Синтез метана в реакции с графитом проходит при повышенном давлении и 600 °С. При более высокой температуре преобладает обратное направление процесса:
2Н2 + С = СН4.
Реакция водорода с азотом протекает достаточно быстро только при 500 °С в присутствии катализатора Fe3O4 при давлении 20-30 МПа:
3Н2 + N2 = 2NH3.
Летучие водородные соединения, в формулах которых первым стоит Н, называют, прочитывая формулы справа налево: НСl — хлороводород, H2S — сероводород, НВг — бромоводород. Названия веществ СН4 — метан, NH3 — аммиак.
В реакциях с металлами водород оказывается окислителем. При нагревании он реагирует с щелочными и щелочноземельными металлами, образуя гидриды:

В гидридах щелочных и щелочноземельных металлов водород находится в степени окисления -1.
Реакции замещения
При нагревании водород реагирует с оксидами многих металлов. Продукты реакции — свободный металл и вода. Реакции замещения с участием водорода — реакции восстановления:
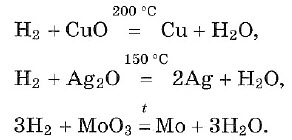
Хром и более активные металлы водородом из соединений не восстанавливаются.
Применение водорода
Раньше водород использовали для наполнения воздушных шаров и дирижаблей. Впоследствии от этого отказались из-за взрыво- и пожароопасности водорода. Сейчас водород — ракетное топливо. Водород необходим для синтеза аммиака NH3 и хлороводорода НСl. С помощью водорода получают особо чистые металлы для полупроводниковой техники. В органической химии с применением водорода получают метиловый спирт СН3ОН, твердые пищевые жиры из растительных масел, синтетическое жидкое топливо. Изотопы водорода — дейтерий 2D и тритий 3Т — термоядерное горючее.
Конспект урока по химии «Химические свойства водорода. Применение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
