Азотная кислота
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты: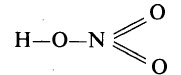
В азотной кислоте степень окисления азота равна +5, а его валентность – IV. Азот не может быть пятивалентным, так как на втором энергетическом уровне нет вакантных орбиталей, необходимых в этом случае для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
При обычных условиях азотная кислота – бесцветная жидкость, примерно в 1,5 раза тяжелее воды, летуча, «дымит» на воздухе, смешивается с водой в любых соотношениях. Часто концентрированный раствор азотной кислоты окрашен в жёлтый цвет, который придаёт раствору оксид азота (IV) NO2, выделяющийся вследствие частичного разложения HNO3.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота является сильной одноосновной кислотой, в водном растворе диссоциирует на ионы: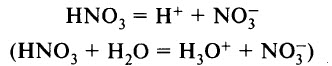
Ион Н3O+ можно обнаружить в растворе с помощью индикатора: лакмус меняет цвет с фиолетового на красный, метиловый оранжевый – с оранжевого на красный.
Азотная кислота проявляет общие свойства кислот. Она реагирует:
- а) со щелочами (реакция нейтрализации):
КОН + HNO3 = KNO3 + H2O
OH– + Н+ = H2O
- б) с нерастворимыми в воде основаниями:
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Mn(OH)2 + 2Н+ = Mg2+ + 2H2O
- в) с амфотерными гидроксидами:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2Н+ = Zn2+ + 2H2O
- г) с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + 2H2O
CuO + 2Н+ = Cu2+ + H2O
- д) с солями слабых и летучих кислот:
К2СO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
СО32– + 2Н+ = CO2↑ + H2O
В то же время в молекуле азотной кислоты содержится атом азота в высшей степени окисления, что обусловливает специфические свойства азотной кислоты.
- Реакция с металлами. Азотная кислота взаимодействует со многими металлами, окисляя их не за счёт Н+, а за счёт азота в высшей степени окисления (+5). В результате таких реакций водород не образуется. Продуктами реакции являются нитрат металла, продукт восстановления азота и вода. Реакция идёт по схеме:
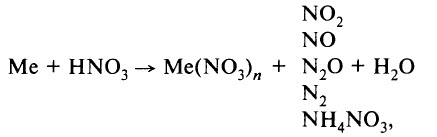
где Me – металл.
В ходе реакции обычно образуется смесь продуктов восстановления азота, и, как правило, один из них преобладает. Глубину восстановления азота иллюстрирует схема:
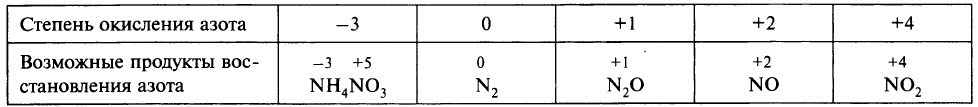
Восстановление азота до NO2 является менее глубоким по сравнению с восстановлением до NO и т. д.
Глубина восстановления азота зависит:
- от природы металла (от восстановительной способности металла; чем левее положение металла в электрохимическом ряду напряжений металлов, тем глубже восстановление азота);
- от концентрации азотной кислоты (в более концентрированных растворах происходит менее глубокое восстановление азота);
- от температуры (понижение температуры способствует более глубокому восстановлению);
- от чистоты азотной кислоты.
С азотной кислотой не реагируют:
- а) благородные металлы Au, Ru, Rh, Os, Ir, Pt вследствие слишком малой их восстановительной способности;
- б) некоторые металлы (Al, Сг, Fe) не реагируют с концентрированной (> 68%) азотной кислотой вследствие образования на поверхности металла плотной защитной оксидной плёнки – эти металлы пассивируются. Тем не менее при нагревании может происходить реакция окисления данных металлов.
Чтобы определить, какой из продуктов восстановления азота преобладает, при записи уравнения реакции можно ориентироваться данными таблицы.
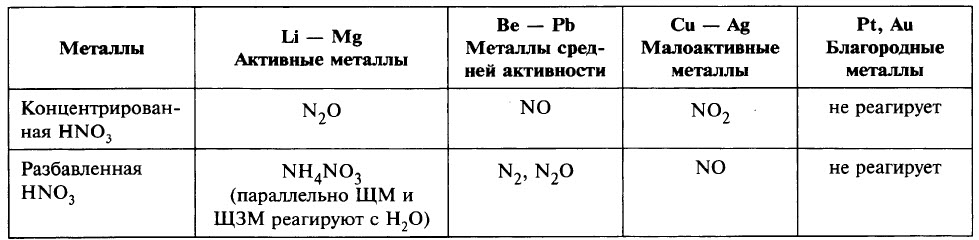
Ещё раз обратим внимание, что в ходе реакции образуется смесь продуктов восстановления и преобладание того или иного продукта зависит от многих факторов.
Классическими примерами взаимодействия азотной кислоты с металлами является растворение меди в азотной кислоте: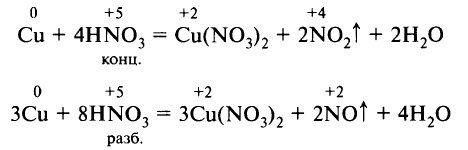
- Реакции с неметаллами. Азотная кислота реагирует с некоторыми неметаллами, способными проявлять восстановительные свойства. Например, концентрированная азотная кислота реагирует с углём, фосфором, йодом. В результате восстановления образуются NO или NO2:
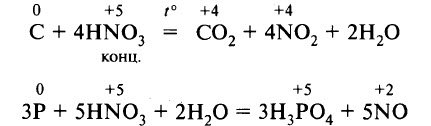
- Реакции со сложными веществами-восстановителями. Концентрированная азотная кислота является сильным окислителем, вступает в реакции с различными веществами, обладающими восстановительными способностями.
- Разложение при нагревании. При хранении, на свету или при нагревании концентрированная азотная кислота разлагается:
![]()
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
В лаборатории чистую азотную кислоту получают нагреванием кристаллической натриевой или калиевой селитры (KNO3, NaNO3) с концентрированной серной кислотой:![]()
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
В основе промышленного получения азотной кислоты находится цепь синтезов:
N2 → NH3 → NO → NO2 → HNO3
Сырьём является азот, получаемый разделением жидкого воздуха на фракции. Сначала осуществляется синтез аммиака: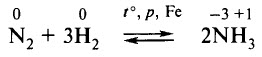
Аммиак окисляют кислородом на платиновом катализаторе:![]()
Оксид азота (II) легко окисляется кислородом воздуха:![]()
В заключение проводят поглощение диоксида азота водой в присутствии избытка кислорода:![]()
Азотная кислота является одной из важнейших неорганических кислот. Её мировое производство достигает десятков миллионов тонн в год. Азотная кислота применяется для производства минеральных удобрений, нитрования органических веществ во многих органических синтезах (чаще всего для синтеза взрывчатых веществ, красителей и лекарств). Примерами органических продуктов нитрования являются нитробензол (требуется для синтеза анилина), тринитротолуол (тротил, тол), тринитроглицерин (для получения динамита), тринитрофенол (пикриновая кислота – взрывчатое вещество), тринитроцеллюлоза и т. д. Азотная кислота используется для травления металлов.
Всё про азотную кислоту кратко в одной таблице
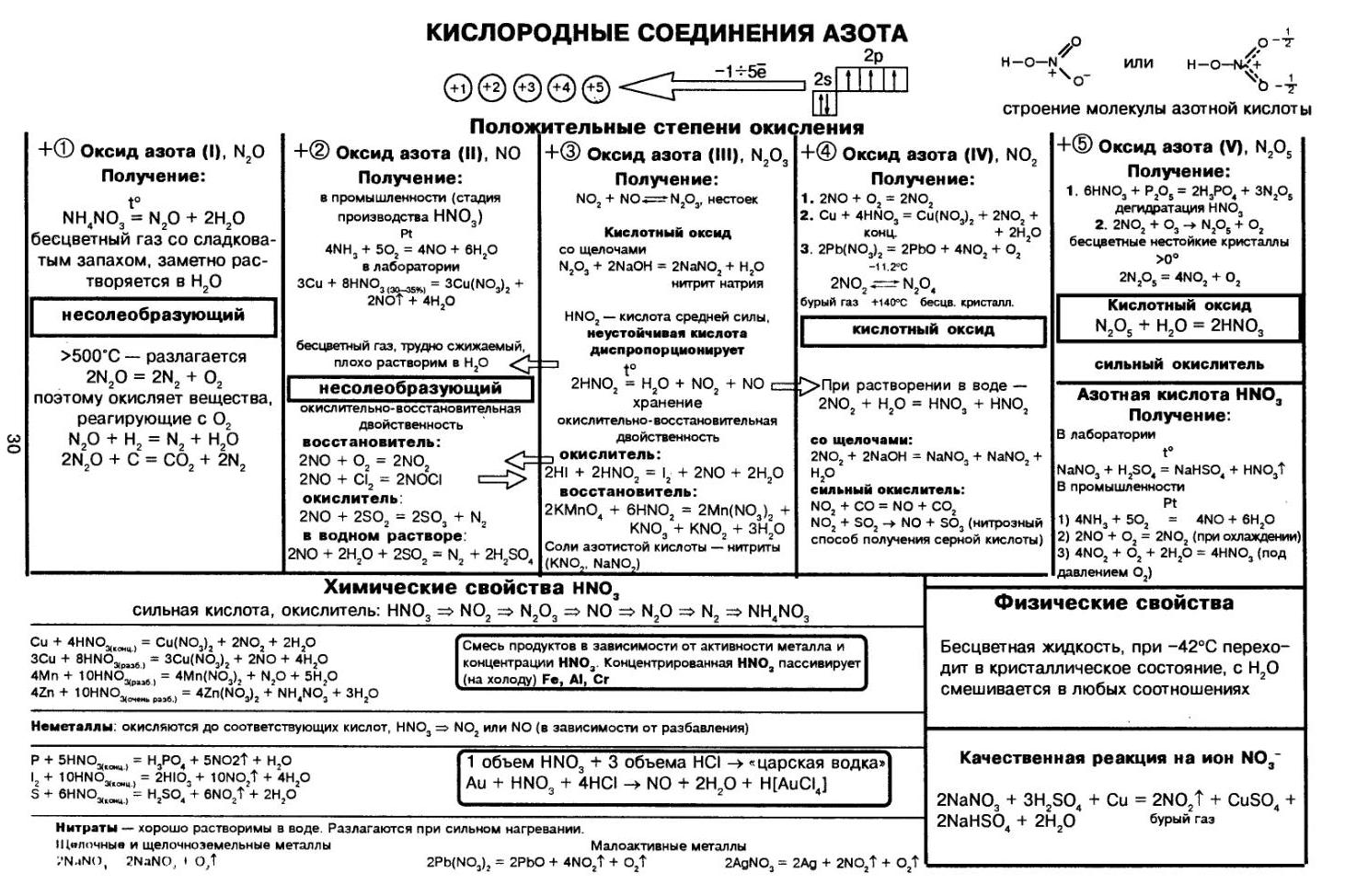
Всё про азотную кислоту кратко в одной таблице
Конспект урока «Азотная кислота: строение, свойства, получение, применение».
Следующая тема: «».

3 Комментарии
Спасибо за конспект. Помогает
Почему некоторые металлы (Al, Cr, Fe) не взаимодействуют с концентрированной HNO3?
В конспекте есть ответ на этот вопрос. «… вследствие образования на поверхности металла плотной защитной оксидной плёнки – эти металлы пассивируются. Тем не менее при нагревании может происходить реакция окисления данных металлов.»