
«Относительная атомная масса.
Относительная молекулярная масса»
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Размеры и массы молекул очень малы. Но размеры и массы атомов ещё меньше. Например, масса самого лёгкого атома — атома водорода равна 1,67375 • 10-24 г, масса атома кислорода — 2,656812 • 10-23 г, а масса атома углерода — 1,9927 • 10-23 г. В результате производить расчёты с такими числами неудобно. Поэтому для измерения атомов и молекул была введена атомная единица массы (а.е.м.)
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
1 а. е. м. = 1,99265 • 10-23 г : 12 = 1,66054 • 10-24 г
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.

Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
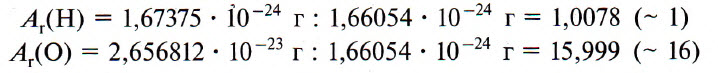
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.

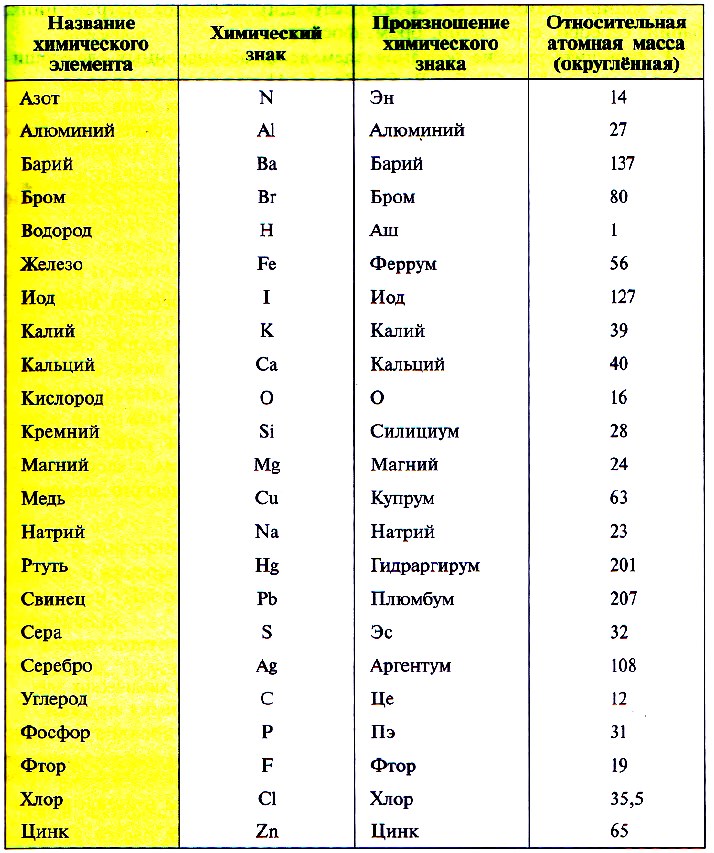
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:

Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Следующая тема: «Закон постоянства состава веществ».

2 Комментарии
Круто.
что это такое я оддин ничего не понял э