
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:
 в которых
в которых
Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:

Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1. Какое количество вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(СО2) = 0,75 моль.
Задача № 2. Какое число молекул содержится в 2,5 моль кислорода?

Ответ: N(O2) = 1,505 • 1024.
Задача № 3. Определите объем (н. у.), который займут 0,25 моль водорода.

Задача № 4. Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?

Задача № 5. Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
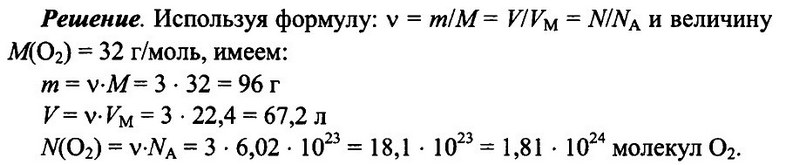
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6. Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
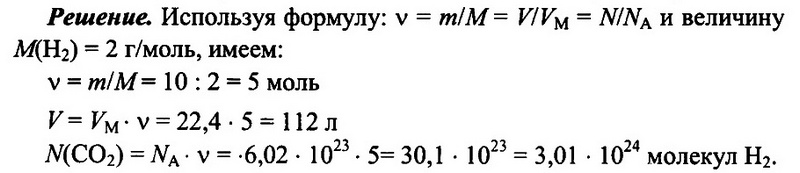
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7. Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.

Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8. Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
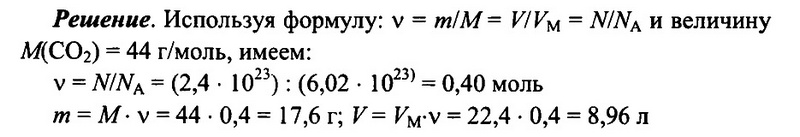
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9. Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?

Задача № 10. Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.

Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.

17 Комментарии
В задаче 2 ошибка в записи условия — v(CO2) там должно быть v(O2)
Спасибо, исправлено.
В задаче 1 ошибка, написано V, должно быть n )
Спасибо вам теперь задачи не надо решать
Чтобы научиться решать задачи, необходимо прорешать не менее 10 задач. Сколько учитель успевает на уроке рассказать как решать задачи? 1-2 задачи. А на дистанте некоторые учителя и вовсе не учат решать задачи: задают почитать теорию, а потом требует решать. А профессиональный учитель всегда найдет пару задач, решения которых нет в Интернете!
СПАСИБО БОЛЬШОЕ, ЗАДАЧИ БЫЛИ СОВСЕМ ЛЕГКИЕ, НЕ ЗНАЮ ПОЧЕМУ ТАМ БЫЛО НАПИСАНО, ЧТО ОНИ СЛОЖНЫЕ. ДА, Я ЧИТАЛА КОММЕНТАРИИ, УЧИТЕЛЯ И ВПРАВДУ НА УРОКАХ САМИ НА ДОСКЕ РЕШАЮТ 1-2 ЗАДАЧИ, ОСТАЛЬНОЕ ДАЮТ ДОМОЙ НАМ. НО ВАМ СПАСИБО ЧТО ДАЕТЕ НАМ ТАКИЕ ЗАДАЧИ НА РАЗМЫШЛЕНИЯ, ЭТО И ВПРАВДУ ПОМОГАЮТ УСЕРДНО ГОТОВИТЬСЯ К УРОКУ, К КОНТРОЛЬНЫМ.
Спасибо за задачи
Хочу доложить об ошибке в 5 задаче. Кол-во молекул кислорода равно 18,06 * 10 в 23 степени, а не 1,81 * 10 в 24 степени.
Это одно и тоже число.
Хочу доложить об ошибке типа «Woman is talking». Дорогой гений химии, ты, к огромнейшему сожалению, не знала о том, что оставляют одну целую часть, увеличивая степень 10-ти. К чему я? Как ты и сказала раннее, совершив сложнейшие вычисления богов, ты получила 18,06*10^23. Оставляя одну целую часть, мы переносим запятую влево, которая, как *10, надбавит ко значению степени единицу. Что же получается? 1,806*10^24. Так как в химии не воспроизводят процесс насилия за округление к сотой части, любезнейший человек записал получившееся так: 1,81*10^24.
чел хорош , но причем тут женщина …
найти массу вступившего в реакцию оксида, если образовалось 20 грамм гидроксида калия. помогите решить плиз.
Запишем уравнение реакции оксида калия с водой:
K2O + H2O = 2KOH (сверху подписываем: над K2O — 1 моль; над 2KOH — 2 моля).
Определим молярные массы:
M(K2O) = 39*2+16 = 94 г/моль.
M(KOH) = 39+16+1 = 56 г/моль.
Определяем количество: v(KOH) = m(KOH) : M(KOH) = 20г : 56г/моль = 0,357 моль.
v(K2O) = v(KOH)/2 = 0,357 : 2 = 0,18 моль.
Находим массу оксида: m(K2O) = v(K2O) * M(K2O) = 0,18 моль * 94 г/моль = 16,92 г.
Ответ: ≈ 17 г.
Помогите решить
в концентрированый раствор с содержанием сульфатной кислоты 0,2 моль добавили 16,25 г цинка, Найти обьём сульфур (4) оксида . который выделился
SO3+H2O = H2SO4
M(SO3) =80г/моль
M(H2O) = 18г/моль
M(H2SO4) =98г/моль
по уравнению 80 г SO3 реагирует с 18 г воды
тогда с 20 г прореагирует х грамм воды
х= 20*18/80=4,5грамм
остальная вода в избытке
масса образовавшейся кислоты 20+4,5 = 24,5грамм
.В процессе фотосинтеза растение поглотило углекислый газ обьемом 680м3.Определте массу образовавшегося картофеля.
1) Процесс фотосинтеза:
6CO2 + 6H2O = 6O2 + C6H12O6 (глюкоза).
2) Находим количество СО2:
n(CO2) = V/Vм = 680 куб.м / 22,4 куб.м/кмоль = 30 кмоль
3) По уравнению видно (показывают коэффициенты), что глюкозы синтезируется в 6 раз меньше, чем затрачивается СО2.
Вычислим из пропорции кол-во вещества (х), массу которого надо найти, используя стехиометрические соотношения:
30 кмоль : х кмоль = 6 моль / 1 моль.
х = 5 кмоль = n(C6H12O6)
4) Молярная масса глюкозы (C6H12O6) составляет 180 г/моль.
Находим массу глюкозы:
m(глюкоза) = n * M = 5 кмоль * 180 кг/кмоль = 900 кг
5) Чтобы найти массу картофеля, нужно учесть коэффициент преобразования массы глюкозы в массу картофеля. Предположим, что масса глюкозы составляет 20% от массы картофеля:
m(картофель) = m(глюкоза) / 0,2 = 900 / 0,2 = 4500 кг.
Использованы алгоритмы типовых задач: https://uchitel.pro/химия-алгоритмы-решения-типовых-зада/