Контрольная работа № 7 по химии в 9 классе «Металлы» с ответами для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 7.
Контрольная работа № 7
«Металлы» (9 класс)
КР-7. Вариант 1
- 1) Составьте электронную формулу и схему распределения электронов по орбиталям атомов натрия.
2) Какие степени окисления натрий проявляет в соединениях? Составьте формулы высшего оксида и гидроксида, а также гидрида натрия.
3) Расположите символы химических элементов (Na, Rb, Li, Cs, К) в порядке:
а) возрастания атомного радиуса
б) возрастания восстановительной способности
в) ослабления основных свойств образуемых гидроксидов. - Какой вид химической связи и тип кристаллической решётки у кальция? Используя значки изобразите схему строения кристалла кальция.

- Из перечисленных металлов — натрий, хром, серебро, ртуть — выберите самый
1) электропроводный _______; 2) пластичный ________; 3) хрупкий ________; 4) тяжёлый ________; 5) мягкий ________; 6) твёрдый _______; 7) легкоплавкий ________. - Приведите пример металла, встречающегося в природе только в виде соединений _______________. Как такой металл получают? Приведите соответствующее уравнение реакции.
- Изучите схему, описывающую химические свойства металлов (см. табл. 28 в учебнике). Приведите по одному примеру для каждой группы реакций. Составьте уравнения соответствующих реакций.
- а) Закончите уравнения реакций:
1) МоO3 + H2 →t→ _________; 4) Zn + NaOH + H2O →t→ _________;
2) К + O2 →t→ __________; 5) Сu + HNO3(конц.) →t→ __________;
3) Fe3O4 + Mg →t→ __________; 6) Аl + H2O →t→ ___________.
б) Хлорид меди(II) можно получить: 1) взаимодействием гидроксида меди(II) с соляной кислотой; 2) растворением в соляной кислоте предварительно обожжённой на воздухе меди; 3) при горении меди в хлоре. Составьте уравнения реакций, укажите, какие из них окислительно-восстановительные. Определите окислитель и восстановитель. Для реакции ионного обмена составьте сокращённое ионное уравнение. - 1) Рассмотрите рисунок. Поясните причину возникновения накипи на чайнике. Какие процессы происходят при кипячении воды? Составьте уравнение реакции. Что такое жёсткость воды? Что такое временная жёсткость?
 2) Что такое коррозия металлов? Перед вами рисунок, на котором изображены два стакана. Какие реакции будут происходить там? В каком стакане реакция прошла быстрее? Почему?
2) Что такое коррозия металлов? Перед вами рисунок, на котором изображены два стакана. Какие реакции будут происходить там? В каком стакане реакция прошла быстрее? Почему? - 1) В пробирку с раствором соли X добавили вещество Y. В результате реакции наблюдали образование металла, имеющего в слитке красный цвет. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию: 1) карбонат калия; 2) сульфат меди(II); 3) цинк; 4) калий. Составьте уравнение реакции: _____________________
2) В четырёх пронумерованных пробирках находятся растворы хлоридов магния, железа(II), алюминия и натрия. Как идентифицировать эти вещества? Составьте план эксперимента и уравнения соответствующих реакций.
| Реактив | FeCl2 | MgCl2 | NaCl | АlСl3 |
| 1) | ||||
| 2) | ||||
| 3) | ||||
| 4) |
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) FeS2 → Fe2O3 → Fe → FeCl2 → Fe(OH)2 → FeSO4
2) Металл красного цвета сожгли в хлоре, а продукт реакции растворили в воде. В полученный раствор добавили щёлочь, выпавший осадок синего цвета отфильтровали и прокалили, при нагревании продукта прокаливания чёрного цвета с коксом был получен исходный металл.
3) Даны вещества: СаСO3, СuО, растворы NaOH, K2SO4, HNO3, H2O2, СаСO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Опишите признаки проводимых реакций. Для одной реакции напишите сокращённое ионное уравнение реакции. - Рассчитайте:
1) массу оксида лития, который образуется при сжигании в кислороде 4,2 г лития.
2) массу алюминия, требуемого для получения водорода (н.у.) из соляной кислоты, необходимого для восстановления оксида меди(II), образовавшегося при разложении 63,7 г гидроксида меди(II).
3) массовую долю металлов в смеси алюминия и меди при взаимодействии 10 г смеси с избытком раствора серной кислоты. При этом выделился водород объемом 6,72 л (н. у.).
Указания по решению заданий Варианта 1:
№ 1. 1) 2; 8; 2; 2) +1, Na2O; NaOH; NaH; 3) a) Li, Na, К, Rb, Cs; б) Li, Na, K, Rb, Cs.
№ 2. Металлическая.
№ 3. 3124124.
№ 4. —.
№ 5. —.
№ 6. a) 1) MoO3 + 3H2 → Mo + 3H2O; б) 1) Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
№ 7. 1) B воде растворены гидрокарбонаты кальция и магния. Они неустойчивы к нагреванию;
2) необходимо сравнить активность металлов, в первую очередь разрушается более активный металл.
№ 8. 1) сульфат меди(II) + цинк; 2) У этих солей разное отношение к раствору щёлочи. Соединения железа(+2) легко окисляются кислородом воздуха и меняют цвет.
№ 9. 1) +O2; +СО; +НСl; +NaOH; +H2SO4;
2) Сu + Cl2 = СuCl2; СuCl2 + 2NaOH = Сu(ОН)2 + 2NaCl; Сu(ОН)2 = СuО + H2O; СuО + С = Сu + СО;
3) СuО + HNO3 →; Cu(NO3)2 + NaOH →.
№ 10. 1) 9 г; 2) 11,7 г; 3) 54%.
Указания по решению заданий Вариантов 2 и 3:
Вы смотрели: Контрольная работа по химии 9 класс «Металлы» с решениями и ответами (3 варианта). Автор работы: Т.А.Боровских. Используется в комплекте с учебником Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 9 класс». Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 7.
Смотреть Список всех контрольных по химии в 9 классе УМК Рудзитис, Фельдман.

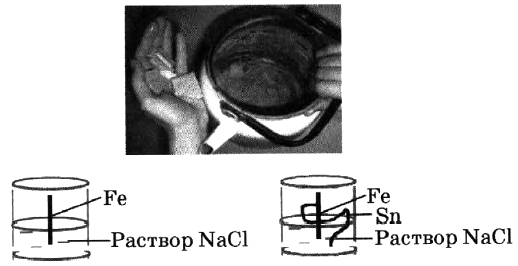 2) Что такое коррозия металлов? Перед вами рисунок, на котором изображены два стакана. Какие реакции будут происходить там? В каком стакане реакция прошла быстрее? Почему?
2) Что такое коррозия металлов? Перед вами рисунок, на котором изображены два стакана. Какие реакции будут происходить там? В каком стакане реакция прошла быстрее? Почему?

2 Комментарии
Во втором варианте ответов допущена ошибка (зад. №9)- натрий в оксиде одновалентен, поэтому формула Na20. Перед водой надо поставить коэффициент 2
Исправлено. Спасибо.