Гидролиз
Ключевые слова конспекта: Гидролиз необратимый и обратимый. Гидролиз солей в зависимости от силы кислот и оснований, образующих соль. Роль гидролиза в обмене веществ. Роль гидролиза в энергетическом обмене.
Слово «гидролиз» (от др.-греч. hydor — вода и lysis — разложение) буквально означает «разложение вещества водой».
| Гидролиз — реакции обменного взаимодействия веществ с водой, приводящие к их разложению. |
Гидролиз бывает необратимым и обратимым.
Если соль образована слабым нерастворимым основанием и слабой летучей кислотой, она существует только в сухом виде, так как в воде полностью разлагается, т. е. подвергается необратимому гидролизу, например:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Кроме некоторых солей, необратимому гидролизу подвергаются многие бинарные (двухэлементные) соединения — фосфиды, нитриды, силициды, гидриды и т. д. Например:
Zn3P2 + 6Н2O = 3Zn(OH)2↓ + 2PH3↑
Эта реакция лежит в основе применения фосфида цинка в качестве зооцида, т. е. вещества, используемого для борьбы с животными-вредителями, прежде всего грызунами.
В органической химии необратимый гидролиз используется для получения ацетилена карбидным способом:
СаС2 + 2Н2O = Са(ОН)2 + C2H2↑
Результаты опыта, наверное, для вас неожиданны: только во второй пробирке индикаторная бумага показала нейтральную среду, тогда как в первой — щелочную, а в третьей — кислотную. Почему? Объяснить результаты эксперимента нам поможет понятие обратимый гидролиз.
Гидролиз солей происходит вследствие взаимодействия катиона металла или аниона кислотного остатка, входящих в состав соли, с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение, в водном растворе появляется избыток катионов водорода или гидроксид–анионов, обусловливающих кислотную или щелочную реакцию среды.
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, карбонат натрия Na2CO3 образован сильным основанием (щёлочью) — гидроксидом натрия NaOH и слабой угольной кислотой Н2СО3.

В зависимости от силы основания и кислоты как электролитов все соли можно разделить на четыре типа. Рассмотрим поведение солей различных типов в водных растворах.
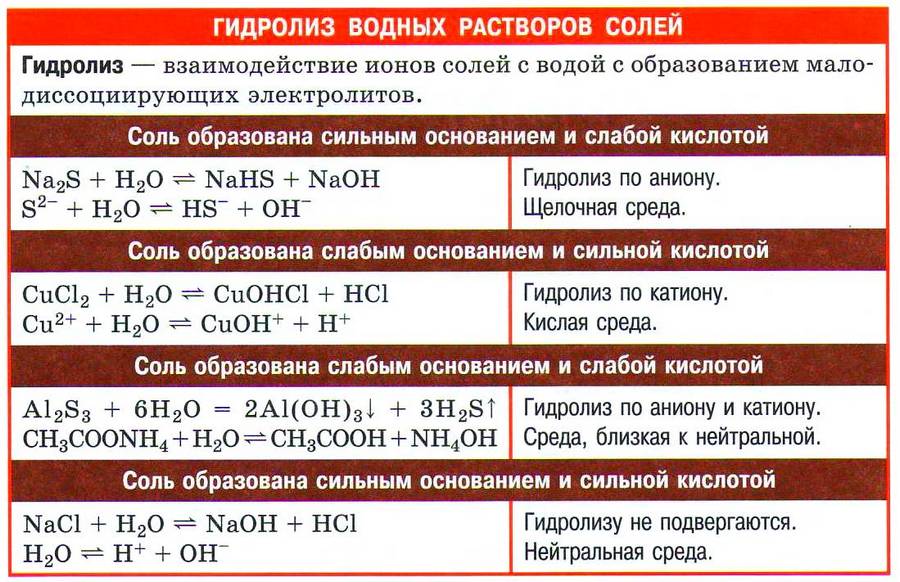
✅ 1. Соли, образованные сильным основанием и слабой кислотой, например карбонат натрия:
Карбонат натрия хорошо растворим в воде и полностью диссоциирует на ионы:![]()
Угольная кислота — слабый электролит. Следовательно, катионы водорода прочно удерживаются карбонат–анионом и с трудом отщепляются в раствор. Верно и обратное: карбонат-анион СО32– легко присоединяет катион водорода Н+, отрывая его у молекулы воды. Карбонат-анион при этом превращается в гидрокарбонат, а от молекулы воды в растворе остаётся анион ОН–:![]()
Мы записали ионное уравнение гидролиза. В результате этого процесса в растворе накапливаются гидроксид-анионы, определяющие щелочную реакцию среды. В данном случае говорят, что идёт гидролиз по аниону.
Молекулярное уравнение гидролиза карбоната натрия имеет вид![]()
✅ 2. Соли, образованные слабым основанием и сильной кислотой. Рассмотрим пример гидролиза хлорида цинка:
В водном растворе хлорид цинка полностью диссоциирует:![]()
Гидролизу подвергается тот ион, который принадлежит слабому электролиту, поэтому данная соль гидролизуется по катиону. Отрывая от молекулы воды гидроксид-анион, катион Zn2+ способствует накоплению в растворе катионов водорода:![]()
Молекулярное уравнение гидролиза легко записать, если в ионном уравнении дописать хлорид-анионы:![]()
Реакцию среды в растворе данной соли определяет наличие катионов Н+: среда кислотная.
✅ 3. Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу по катиону и по аниону. Катион и анион делят между собой молекулу воды, присоединяя соответственно гидроксид–анион и катион водорода. Например, ацетат аммония: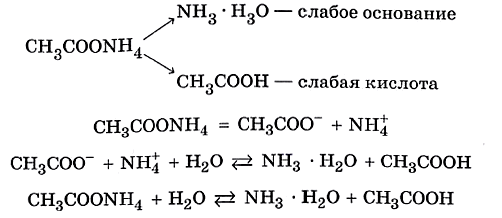
В растворе ацетата аммония среда нейтральная, поскольку нет избытка ни катионов водорода, ни гидроксид-анионов.
Необратимо гидролизуются и по катиону, и по аниону соли слабого нерастворимого основания и слабой летучей кислоты, что было рассмотрено в начале конспекта.
✅ 4. Не гидролизуются соли, образованные сильным основанием и сильной кислотой. В водном растворе подобных солей катионы металла (щелочного или щёлочноземельного) и анионы кислотного остатка окружены гидратными оболочками, взаимодействия с молекулами воды не происходит, поскольку это не приводит к образованию слабого электролита. Реакция среды в растворе таких солей нейтральная.
Термин «гидролиз» не должен ассоциироваться только с гидролизом солей. Это понятие значительно шире, а гидролиз солей – это лишь небольшая часть химических процессов, связанных с разложением веществ водой.
Реакции разложения органических соединений водой также называются гидролизом. Эти реакции играют исключительно важную роль и в промышленности, и в биологических процессах. В курсе органической химии вы изучали гидролиз сложных эфиров, ди- и полисахаридов, белков и других органических веществ.
Существует особая отрасль деревообрабатывающей промышленности, которая так и называется — гидролизная. Малоценные отходы лесопереработки (щепа, опилки, стружки), содержащие до 50% органического полисахарида целлюлозы, нагревают при повышенном давлении в присутствии серной кислоты (в качестве катализатора). В результате происходит гидролиз целлюлозы с образованием её мономера — глюкозы:![]()
Полученные глюкозо-содержащие сиропы сбраживают и получают гидролизный этиловый спирт:![]()
Важное значение имеют процессы гидролиза в живой природе. Основными компонентами пищи человека являются жиры, белки и углеводы. В пищеварительном тракте они подвергаются гидролизу с образованием аминокислот, глицерина и жирных кислот, глюкозы. Из этих «строительных кирпичиков» организм синтезирует свои собственные белки, жиры и углеводы.
Основу жизненных процессов составляет не только обмен веществ, но и обмен энергии. В энергетическом обмене главную роль играет аденозинтрифосфорная кислота (АТФ). Её молекулы гидролизуются с отщеплением остатков фосфорной кислоты и высвобождением энергии (40—60 кДж/моль):
АТФ + вода —> АДФ + фосфорная кислота + энергия
Энергия расходуется на основной обмен (поддержание температуры, рост клеток, движение и др.).
В ходе обратной реакции выделяемая за счёт окисления органических веществ энергия вновь накапливается в АТФ, которая синтезируется из аденозиндифосфорной кислоты (АДФ):
АДФ + фосфорная кислота + энергия —> АТФ + вода
Следовательно, процессы гидролиза — химический фундамент процессов ассимиляции и диссимиляции, лежащих в основе жизни на Земле.
Конспект урока по химии «Гидролиз». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
