Ионная химическая связь и
ионные кристаллические решётки
Ключевые слова конспекта: Катионы как продукт окисления атомов металлов. Анионы как продукт восстановления атомов неметаллов. Ионная химическая связь. Ионная кристаллическая решётка. Простые и сложные ионы.
Опираясь на знания из курса основной школы, вы, возможно, предложите следующие способы:
- металлы, атомы которых содержат на внешнем слое 1—3 электрона, могут отдать их, чтобы сделать завершённый предвнешний слой внешним;
- неметаллы, атомы которых содержат на внешнем слое 4—7 электронов, могут принять недостающие чужие электроны для завершения этого слоя.
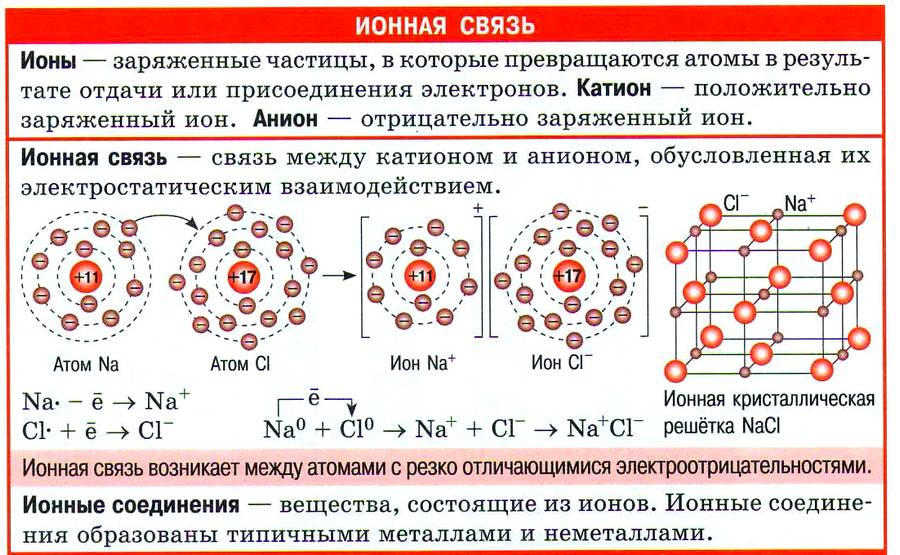
Однако эти процессы имеют далеко идущие последствия. Во–первых, атомы металлов, отдавая электроны (процесс называется окислением), превращаются в положительно заряженные ионы — катионы, а во–вторых, атомы неметаллов, принимая электроны на внешний слой (процесс называется восстановлением), превращаются в отрицательно заряженные ионы — анионы.
Согласно закону Кулона, между катионами и анионами возникают силы электростатического притяжения, которые удерживают эти частицы в ионном кристалле.
| Связь, образованная за счёт электростатического притяжения между катионами и анионами, в которые превращаются атомы или группы атомов в результате отдачи и присоединения электронов, называется ионной. |
Эта связь характерна для соединений, образованных наиболее активными металлами — щелочными и щёлочноземельными, и наиболее активными неметаллами — галогенами и кислородом. Следовательно, из бинарных, или двухэлементных соединений, к ионным относятся оксиды и галогениды металлов IA- и IIА-групп. Эти соединения построены простыми ионами.
Схематично процесс образования ионной связи между атомами кальция и хлора можно отразить следующим образом: ![]()
Два разноимённо заряженных иона, связанных силами взаимного притяжения, взаимодействуют с другими противоположно заряженными ионами, образуя таким образом кристаллические соединения. Что они собой представляют?
Ионы, как и другие частицы, в твёрдом кристалле занимают строго определённое положение в пространстве. Если их соединить воображаемыми линиями, получится совокупность ячеек правильной геометрической формы, называемая кристаллической решёткой. Точки, в которых расположены частицы вещества (в нашем случае ионы), называют узлами кристаллической решётки.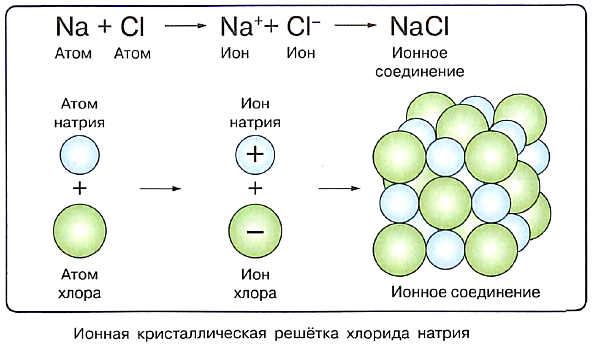
На рисунке представлена модель кристаллической решётки другого ионного соединения — хлорида натрия NaCl. В нём каждый катион натрия окружён шестью хлорид-анионами. Те, в свою очередь, окружены каждый шестью катионами натрия.
Ионы в узлах кристаллической решётки могут колебаться, но перемещаться им мешают другие ионы. Силы взаимного притяжения ионов достаточно велики, поэтому при обычных условиях вещества ионного строения имеют твёрдое агрегатное состояние, высокую температуру плавления, они нелетучие, а потому без запаха. Некоторые из таких веществ хорошо растворимы в воде (гидроксиды щелочных и щёлочноземельных металлов, соли).
Ионные кристаллы хрупкие, поскольку при смещении слоёв одинаково заряженные ионы сближаются друг с другом, что приводит к их взаимному отталкиванию.
При сильном нагревании колебание ионов увеличивается настолько, что порядок нарушается и кристалл плавится. Из каких частиц будет состоять полученная жидкость? Очевидно, из тех, которые были в узлах кристаллической решётки, т. е. из ионов.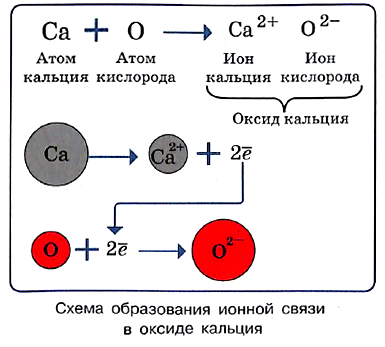
На рисунке показана схема образования ионной связи в оксиде кальция СаО, хорошо известного под названием «негашёная известь».
В определении ионной связи есть уточнение: ионы образуют не только отдельные атомы, но и группы атомов. Следовательно, существуют и сложные ионы, состоящие из нескольких химических элементов. Например, гидроксид-анион ОН–, анионы кислотных остатков кислородсодержащих кислот — сульфат–анион SO42–, нитрат анион NO3– и др. Логично сделать вывод, что ионными соединениями являются щёлочи и соли.
Поскольку соединения с ионной связью относятся к веществам немолекулярного строения, более точным термином, отражающим их состав, является термин «формульная единица», а не «молекулярная формула». Однако в силу традиций последнее название часто употребляется и в отношении ионных соединений.
Ионную связь можно рассматривать как крайнюю степень полярности ковалентных связей. Даже в тех соединениях, которые считаются абсолютно ионными, например в хлориде натрия, отсутствуют ионы с целочисленными значениями зарядов (+1 и –1). Действительный заряд на катионе натрия и хлорид–анионе соответственно равен +0,8 и –0,8.
Не является абсолютно истинным и утверждение о том, что ионная связь возникает между элементами с противоположными свойствами — между активными металлами и неметаллами. Имеются ионные соединения, построенные только из неметаллов. К ним, например, можно отнести соли аммония (сульфат аммония, хлорид аммония и др.), а также соли органических оснований — аминов (хлорид метиаламмония, нитрат этиламмония и др.).
Теорию ионной связи предложил немецкий учёный Вальтер Коссель.
Конспект урока по химии «Ионная химическая связь и ионные кристаллические решётки «. В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии

1 Комментарий
Ион хлора на последнем энергетическом уровне имеет 8 электронов, а у вас в опорном конспекте 7 электронов. Это не верно. Атом хлора на последнем энергетическом уровне имеет 7 электронов. И еще: когда пишете атом хлора, то электроны последнего энергетического уровня обозначают в виде точек ( две сверху, две точки снизу, две точки слева и одна точка справа посередине. У вас обозначена только одна точка справа у атома хлора.
..
: Cl —
..
не получается у меня обозначить точки снизу и справа в центре. Ионы — это положительные или отрицательные частицы, в которые превращаются атомы в результате отдачи и присоединения электронов.