Закономерности изменения свойств элементов
Элемент ЕГЭ: 1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам.
Современная формулировка Периодического закона Д.И. Менделеева: свойства элементов, а также образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атома, равного порядковому номеру элемента.
Периодическая система химических элементов — естественная классификация химических элементов, являющаяся табличным выражением Периодического закона Д.И. Менделеева. Она представляет собой таблицу, состоящую из периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов.

Периоды (горизонтальные ряды)
Период — горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов, начинающийся щелочным металлом (1-й период — водородом) и заканчивающийся инертным газом.


Современная Периодическая система включает 7 периодов. Каждый период начинается элементом, в атоме которого впервые появляется электрон на соответствующем энергетическом уровне (водород или щелочной элемент), и заканчивается элементов, в атоме которого до конца заполнен уровень с тем же номером (благородный газ).
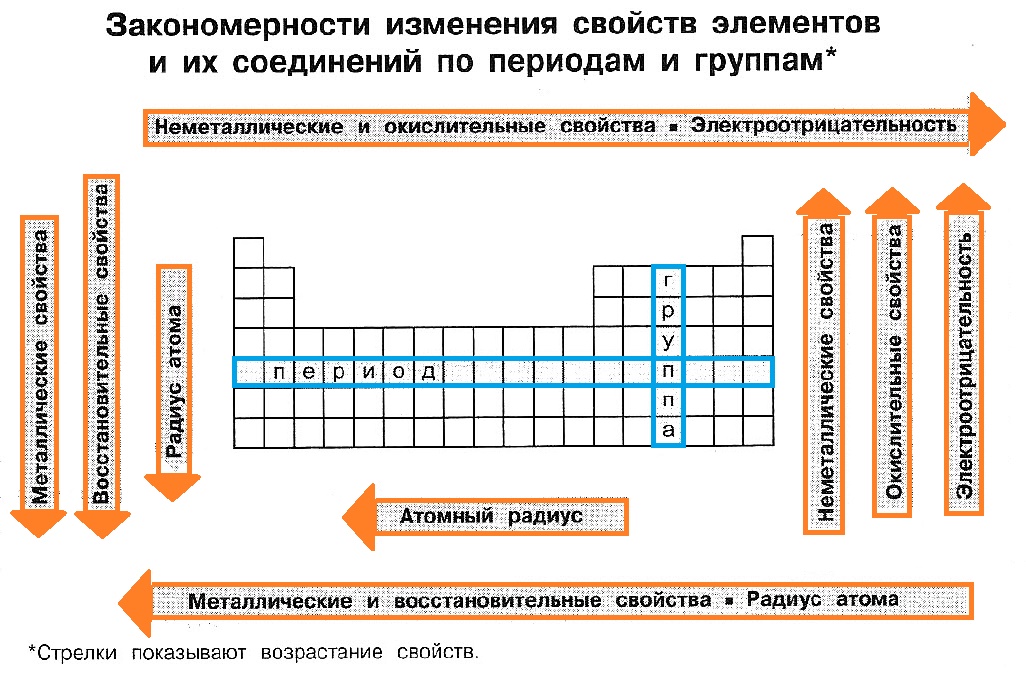
В группе:
- число электронов на последнем электронном уровне (ЭУ) не изменяется;
- радиусы атомов в целом возрастают;
- электроотрицательность (способность атома в соединении удерживать электроны) в целом уменьшается;
- металлические и восстановительные свойства простых веществ усиливаются;
- неметаллические и окислительные свойства простых веществ ослабевают;
- основные свойства оксидов и гидроксидов в целом усиливаются;
- кислотные свойства оксидов и гидроксидов в целом ослабевают.
Группы (вертикальные столбцы)
Группа — вертикальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов, имеющих одинаковую электронную конфигурацию внешних энергетических уровней.
В короткопериодном варианте Периодической системы — 8 групп. Они разделены на подгруппы А (главные) и Б (побочные). Главные подгруппы содержат s- и р-элементы. Побочные подгруппы содержат d- и f-элементы.
В длиннопериодном варианте Периодической системы — 18 групп. Их обозначают или так же, как в короткопериодном варианте, или просто номерами от 1 до 18 (например, группа IA или 1, VIIБ или 17).
В периоде:
- увеличивается число электронов на последнем ЭУ (от 1 до 8);
- число ЭУ не изменяется;
- радиусы атомов в целом уменьшаются;
- электроотрицательность (способность атома в соединении удерживать электроны) увеличивается;
- металлические и восстановительные свойства простых веществ ослабевают;
- неметаллические и окислительные свойства простых веществ усиливаются;
- основные свойства оксидов и гидроксидов ослабевают;
- кислотные свойства оксидов и гидроксидов усиливаются.
Примеры работы с периодической системой
Пример № 1. Сера.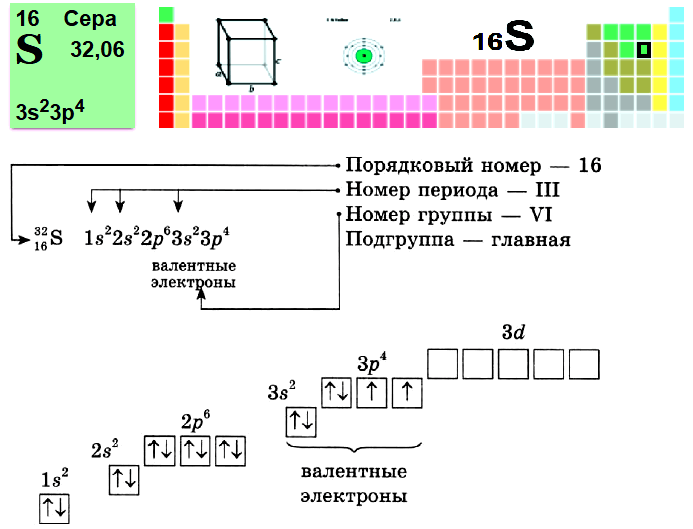
Пример № 2. Титан.

Периодическое изменение свойств элементов и их соединений (наглядно)

Распределение элементов на металлы и неметаллы

Чёткой границы нет. Есть элементы с переходными свойствами.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Закономерности изменения свойств элементов и их соединений по периодам и группам». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Конспект урока в 8 классе «Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов»
