Основные положения
теории химического строения
Ключевые слова конспекта: Теория химического строения органических соединений. Валентность. Структурная формула. Простые (одинарные) связи. Кратные (двойные и тройные) связи. Изомеры. Изомерия. Взаимное влияние атомов в молекуле.
Предпосылки создания теории химического строения
По мере накопления химических знаний учёные овладели умением не только выделять органические вещества из природных объектов, но и проводить реакции с участием таких соединений. Так накапливались знания о свойствах органических веществ, расширялись области их практического применения.
В начале XIX в. учёными-химиками были разработаны методы определения качественного и количественного состава органических веществ. Стало возможным получить ответ на вопрос, какие химические элементы входят в состав этих соединений и каково их соотношение. Однако учёные тогда ещё не могли объяснить, как атомы соединяются в молекулы, не могли записывать качественный и количественный состав веществ с помощью формул; химические реакции описывали словами. Выдающийся немецкий химик того времени Ф. Вёлер писал: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть…»
К середине XIX в. возникла необходимость осмысления, объяснения и обобщения накопившихся данных в области органической химии, т. е. создания научной теории, которая позволила бы систематизировать и объяснять строение и свойства органических веществ.
В первой половине XIX в. учёными разных стран были предприняты попытки создания подобной теории. Одни основывались на сходстве качественного и количественного состава родственных органических веществ, другие — на общности химических свойств. Однако подобно тому, как первые попытки классификации химических элементов не превратились в научную теорию, а стали лишь предтечей открытия Д. И. Менделеевым периодического закона, так и ранние попытки систематизации знаний об органических веществах явились предпосылками создания теории химического строения органических соединений.
Первое положение теории химического строения.
Структурные формулы
Первую научную теорию строения органических соединений, которой химики всего мира придерживаются до сих пор, предложил выдающийся русский учёный А. М. Бутлеров. Основные идеи новой теории впервые были высказаны им в 1861 г. в докладе «О химическом строении вещества» на съезде естествоиспытателей и врачей в немецком городе Шпайере.
Основой теории Бутлерова является положение о химическом строении как определённой последовательности химических связей между атомами в молекулах в строгом соответствии с их валентностью. Рассмотрим основные положения теории химического строения.
| Первое положение. Атомы в молекулах соединены друг с другом согласно их валентности, причём углерод в органических веществах всегда четырёхвалентен, а его атомы способны соединяться в цепи линейного, разветвлённого и замкнутого строения. |
Напомним, что валентность — это способность атомов химических элементов образовывать определённое число связей с другими атомами. Для соединений с ковалентными связями валентность равна числу общих электронных пар данного атома с соседними атомами.
Наглядно продемонстрировать валентность атомов в молекуле можно с помощью структурных формул. Структурная формула — это такое изображение молекулы, в котором каждая ковалентная химическая связь показана чёрточкой — валентным штрихом.
В органических соединениях углерод проявляет постоянную валентность, равную четырём. Например, структурная формула простейшего углеводорода метана СН4 имеет вид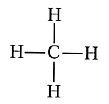
Атомы углерода обладают уникальной способностью образовывать связи не только с атомами других элементов, но и друг с другом; при этом возникают различные цепи — линейные, разветвлённые, замкнутые: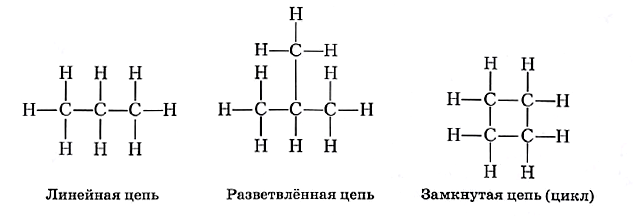
Атомы углерода во всех приведённых примерах четырёхвалентны и образуют между собой и с атомами водорода простые, или одинарные, связи.
Но этим уникальные особенности атомов углерода как химического элемента не исчерпываются. Два атома могут быть связаны между собой и с другими атомами не только простыми, но и кратными, т. е. двойными или даже тройными, связями, например: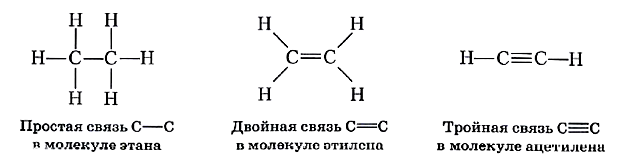
Теперь вам становится понятна одна из причин многообразия органических соединений. Она заключается в том, что атомы углерода способны образовывать между собой ковалентные химические связи (простые и кратные), соединяясь в цепи (неразветвлённые, разветвлённые, циклические).
Второе положение теории
химического строения. Изомерия
| Второе положение. Свойства органических веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением. |
Чтобы описать свойства какого-либо органического вещества, например имеющего формулу C2H2О, недостаточно информации о качественном и количественном составе вещества. Необходимо знать, в каком порядке атомы соединены в молекуле. Подобно тому, как из одного и того же набора кубиков можно сложить домики разной «архитектуры», так и из двух атомов углерода, шести атомов водорода и одного атома кислорода можно без нарушения валентности «построить» различные молекулы: 
Первое вещество — этиловый спирт и второе — диметиловый эфир имеют одинаковый состав, но их физические и химические свойства различны. Вы впервые встретились с очень распространённым в органической химии явлением — изомерией.
Вещества, имеющие одинаковый качественный и количественный элементный состав, но различное химическое строение, а следовательно, и различные свойства, называют изомерами. Явление существования изомеров называют изомерией.
А. М. Бутлеров не только впервые объяснил существование изомеров различием в химическом строении молекул, но и сумел предсказать существование изомеров для уже известных веществ, а затем и синтезировать их. В этом заключается выдающаяся предсказательная роль теории строения.
Таким образом, молекулярная формула отражает только качественный и количественный состав вещества. Информацию о химическом строении соединения несёт структурная формула, указывающая на порядок связи атомов в молекулах. Помимо полной структурной формулы наподобие тех, которые изображены выше, на практике чаще используют сокращённые структурные формулы, сворачивая близлежащие группы атомов, не записывая ненужные при этом валентные штрихи. Например, особенности строения этилового спирта и диметилового эфира вполне однозначно передают формулы:
СН3—СН2—ОН СН3—О—СН3
Более детальную информацию о химическом строении вещества, в частности о взаимном расположении атомов в пространстве, дают объёмные модели молекул — модели Стюарта—Бриглеба.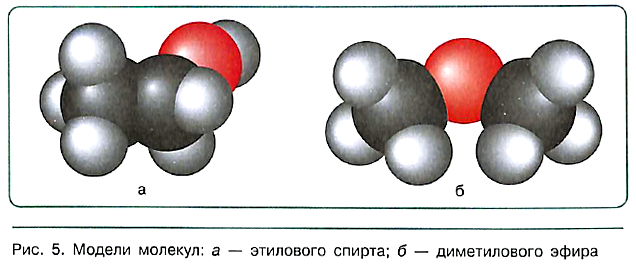
Явление изомерии — ещё одна причина многообразия органических соединений.
Третье положение теории химического строения
| Третье положение. Атомы в молекулах органических веществ оказывают влияние друг на друга. |
Нетрудно догадаться, что этот «особенный» атом, в отличие от пяти остальных, не соединён с углеродом непосредственно, а связан с ним через атом кислорода. Следовательно, атом кислорода влияет на соседний с ним атом водорода, облегчая его замещение атомом натрия.
В молекуле диметилового эфира все атомы водорода связаны только с атомами углерода. Становится понятно, почему, в отличие от этилового спирта, диметиловый эфир не способен реагировать с металлическим натрием.
Теория химического строения, предложенная А. М. Бутлеровым, сыграла в органической химии такую же огромную роль, как периодический закон и периодическая система элементов Д. И. Менделеева в неорганической химии. Она позволила систематизировать все накопленные сведения об органических веществах и объяснить причины их многообразия. Но самое главное — теория строения сделала осмысленным и целенаправленным синтез новых органических веществ и изучение их химических свойств. Она настолько многогранна и динамична, что и сегодня является основополагающим учением не только органической, но и всей современной химии.
Основные выводы по теме конспекта:
- Научной основой органической химии является современная теория химического строения органических соединений. Некоторые положения этой теории:
- атомы в молекулах соединены друг с другом согласно их валентности, причём углерод в органических веществах всегда четырёхвалентен;
- свойства веществ зависят не только от их качественного и количественного состава, но и от их строения (химического, электронного и пространственного);
- атомы в молекулах влияют друг на друга.
- Химическим строением называют порядок расположения атомов в молекуле согласно их валентности.
- Химическое строение отображают с помощью химических формул: молекулярных и структурных (полных или сокращённых).
- Материальные модели, отражающие состав и пространственное строение молекул органических соединений, бывают двух видов: шаростержневые и объёмные.
- Причины многообразия органических веществ — это: способность атомов углерода соединяться друг с другом, образуя различные цепи (линейные, разветвлённые, циклические); способность атомов углерода образовывать связи различной кратности (одинарные, двойные, тройные); явление изомерии.
Конспект урока по химии «Основные положения теории химического строения». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
