Контрольная работа № 1 по химии в 9 классе «Классификация химических реакций» с ответами (3 варианта) для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 1.
Контрольная работа № 1
«Классификация химических реакций»
КР-1. Вариант 1
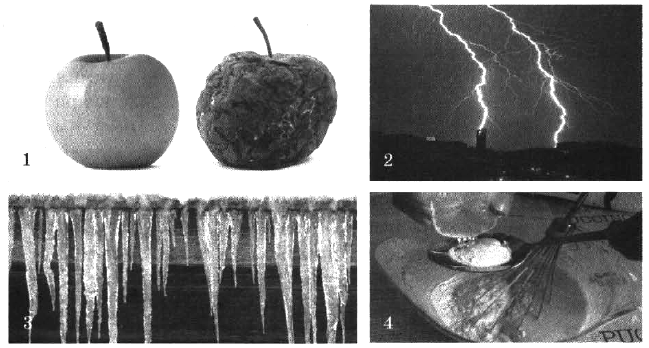
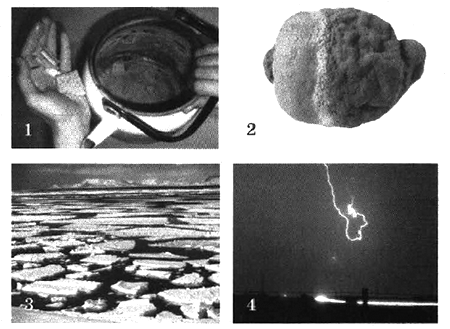
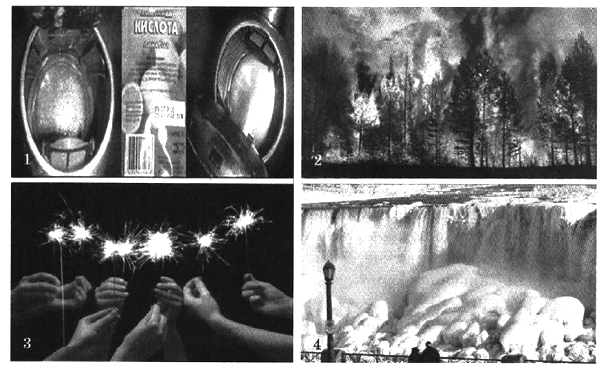
- Дайте определение окислительно-восстановительным реакциям. На каких рисунках изображены окислительно-восстановительные реакции? Ответ обоснуйте.

- Определите степени окисления элементов и роль (окислитель/ восстановитель) частицы в ОВР, название процесса (окисление/ восстановление) и число электронов, принимающих в них участие:
а) по формуле соединения (полученные значения запишите над символами элементов) для выделенных соединений определите, окислителем или восстановителем оно является в ОВР
NaH, PbO, SiO2, SO3, Р2O3, Li3N, PbO2, N2O5, КСlO3, K2MnO4.
б) по следующим схемам:
1) 2Вг– – 2е → Вг2х= ______; 4) Сl+5 + 6е → Сlх= ______
2) Fe0 – 3e → Fex= _______; 5) S+6 ______ → S+4 ______
3) O20 + 4е → 2Oх= ______; 6) S0 ______ → S+6 ______ - Расставьте коэффициенты в схемах ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
1) _КСlO3 + _S → _КСl + _SO2
2) _KMnO4 + _H2S + ______ = _MnSO4 + _S + ___ + ____ - Дан ряд веществ: оксид меди(II), соляная кислота, гидроксид калия, водород, карбонат натрия. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
- Проведите вычисления, связанные с тепловым эффектом химической реакции:
1) Определите количество теплоты, которое выделится при обжиге 720 г FeS2 согласно термохимическому уравнению реакции 4FeS2 (TB.) + 11О2(Г) = 8SО2(Г) + 2Fe2О3(TB) + 3310 кДж.
2) При соединении 2,3 г натрия с хлором выделяется 20,57 кДж теплоты. Составьте термохимическое уравнение реакции. - Химическая реакция протекает по уравнению 3А + В = С. По приведённым в таблице экспериментальным данным рассчитайте концентрации веществ через 30 минут после начала реакции и среднюю скорость реакции в данном промежутке времени.

- При повышении температуры на 10 °С скорость некоторой реакции возрастает в 2 раза. При 20 °С скорость реакции равна 0,04 моль/(л • ч). Какова будет скорость этой реакции при 30 °С?
Постройте график зависимости скорости реакции от температуры для данных условий. - Проанализируйте возможность изменения скорости реакции:
1) Приведите все факторы, способствующие увеличению скорости химической реакции FeO(TB.) + СО (Г) → Fe (TB.) + СО2 (Г).
2) Перечислите факторы, которые не влияют на скорость реакции 2С(TB.) + СО2(Г) = 2СО(Г) - 1) Рассмотрите факторы, влияющие на состояние равновесия реакции N2(Г)+ О2(Г) ⇔ 2NO(Г) – Q.
2) Какие факторы позволят сместить равновесие в системе в сторону продуктов реакции I2(Г) + Сl2(Г) ⇔ 2IСl(Г) + Q?
Ответы на задания Варианта 1
Химия 9 Рудзитис Контрольная работа 1. Вариант 2
- Дайте определение окислительно-восстановительным реакциям.
На каких рисунках изображены окислительно-восстановительные реакции? Ответ обоснуйте.
- Определите степени окисления элементов и роль (окислитель и восстановитель) частицы в ОВР, название процесса и число электронов, принимающих в них участие:
а) по формуле соединения (полученные значения запишите над символами элементов) для выделенного соединения определите, окислителем или восстановителем оно является в ОВР
SiF4, HBr, СuСl2, РСl3, NaBr, Na3N, Mg2Si, NaNO3, K3PO4, Al2(SO4)3
б) по следующим схемам:
1) 2Сl– – 2е → Сl2x= ______; 4) N+5 + 8e → Nx= _______
2) Аl0 – 3е → Аlx= ______; 5) Mn+7 ______ → Mn+4 _______
3) N20 + 6е → 2Nx= _______; 6) N+2 _____ → N+4 _______ - Расставьте коэффициенты в схемах ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
1) _КМnO4 + _KBr + _H2SO4 = _MnSO4 + Br2 + K2SO4 + H2O
2) _FeSO4 + _KMnO4 + ______ = _Fe2(SO4)3 + _MnSO4 + _____ + _____ - Дан ряд веществ: оксид железа(II), гидроксид натрия, оксид углерода(II), серная кислота, карбонат кальция. Из предложенного перечня выберите вещества, между которыми возможна окислительно–восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
- Проведите вычисления, связанные с тепловым эффектом химической реакции:
1) Термохимическое уравнение сгорания железа:
4Fe + 3O2 = 2Fe2O3 + 1646 кДж.
В результате реакции выделилось 2057,5 кДж. Определите массу образовавшегося при этом оксида железа(III).
2) При сгорании 1,3 г цинка выделяется теплота количеством 6,96 кДж. Составьте термохимическое уравнение этой реакции. - Химическая реакция протекает по уравнению А + В = 2С. По приведённым в таблице экспериментальным данным рассчитайте концентрации веществ через 30 минут после начала реакции и среднюю скорость реакции в данном промежутке времени.

- При повышении температуры на 10 °С скорость некоторой реакции возрастает в 2 раза. При 20 °С скорость реакции равна 0,04 моль/(л • ч). Какова будет скорость этой реакции при 40 °С?
Постройте график зависимости скорости реакции от температуры для данных условий. - 1) Рассмотрите факторы, способствующие увеличению скорости реакции 2NO2(Г) = 2NO(Г) + О2(Г).
2) Перечислите факторы, которые не влияют на скорость реакции Zn + CuCl2 = ZnCl2 + Сu. - 1) Рассмотрите факторы, влияющие на состояние равновесия на примере системы 2SO2 + O2 ⇔ 2SO3 + Q.
2) Определите, какие факторы позволят сместить равновесие в сторону продуктов реакции на примере системы Fe2O3(ТВ) + 3СО(Г) ⇔ 2Fe(TB.) + 3СO2(Г) + Q.
Ответы на задания Варианта 2
Химия 9 Рудзитис Контрольная работа 1. Вариант 3
- Дайте определение окислительно-восстановительным реакциям.
На каких рисунках изображены окислительно-восстановительные реакции? Ответ обоснуйте.
- Определите степени окисления элементов и роль (окислитель и восстановитель) частицы в ОВР, название процесса и число электронов, принимающих в них участие:
а) по формуле соединения (полученные значения запишите над символами элементов) для выделенного соединения определите, окислителем или восстановителем оно является в ОВР
CuCl, SbCl3, P2O5, N2O3, MnO, CrO3, Na2S, Al4C3, Zn(NO3)2, HNO3
б) по следующим схемам:
1) 2N–3 – 6е —> N2x= _____; 4) N+5 + 3е —> Nx= ______
2) Са0 – 2е —> Сах= _____; 5) Сг+6 ______ —> Сг+3 ______
3) Сl20 + 2е —> 2Сlх= ______; 6) N–3 _____ —> N+2 _____ - Расставьте коэффициенты в схемах ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
1) _KNO2 + _КМnO4 + _Н2O = _KNO3 + _МnO2 +_КОН
2) _KMnO4 + _KBr + ____ = _MnSO4 + Вг2 + ___ + ____ - Дан ряд веществ: оксид хрома(III), серная кислота, гидроксид натрия, алюминий, сульфит натрия. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
- Проведите вычисления, связанные с тепловым эффектом химической реакции:
1) Дано термохимическое уравнение: 2С(ТВ.) + Н2(Г) = С2Н2(Г) – 228 кДж. В реакции поглотилось 95 кДж теплоты. Определите массу углерода, вступившего в реакцию.
2) При полном восстановлении 48 г оксида железа(III) избытком алюминия выделилось 256,2 кДж теплоты. Составьте термохимическое уравнение этой реакции. - Химическая реакция протекает по уравнению А + 2В = С. По приведённым в таблице экспериментальным данным рассчитайте концентрации веществ через 30 минут после начала реакции и среднюю скорость реакции в данном промежутке времени.

- При повышении температуры на 10 °С скорость некоторой реакции возрастает в 2 раза. При 20 °С скорость реакции равна 0,04 моль/(л•ч). Какова будет скорость этой реакции при 10 °С?
Постройте график зависимости скорости реакции от температуры для данных условий. - Рассмотрите факторы, которые влияют или нет на скорость химической реакции.
1) Приведите все факторы, способствующие увеличению скорости химической реакции 2CuS(ТВ.) + 3О2(Г) = 2CuO(ТВ.) + 2SО2(Г).
2) Перечислите факторы, которые не влияют на скорость реакции СаО(TB.) + 3С(ТВ.) = СаС2(ТВ.) + СО(Г). - 1) Рассмотрите все факторы, влияющие на состояние равновесия на примере системы СО2(Г) + С(ТВ.) ⇔ 2СО(Г) – Q.
2) Определите, какие факторы позволят сместить равновесие в сторону продуктов реакции на примере системы 3O2(Г) ⇔ 2O3(Г) – Q.
Ответы на задания Варианта 3
Вы смотрели: Контрольная работа по химии 9 класс «Классификация химических реакций» с решениями и ответами (3 варианта). Автор работы: Т.А.Боровских. Используется в комплекте с учебником Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 9 класс». Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 1.
Смотреть Список всех контрольных по химии в 9 классе УМК Рудзитис, Фельдман.

3 Комментарии
спасибо очень обьемная работа для 40 мин, частично использовала бы но не скачивается
У нас нет разрешения от автора на скачивание, только ссылка на покупку пособия.
большое спасибо хорошо подобраны задания.